§ 3. Асноўныя класы неарганічных злучэнняў
Рэчывы, якія вывучаюцца, класіфікуюць з улікам саставу, будовы, уласцівасцей і іншых крытэрыяў. Асноўнымі класамі простых рэчываў з’яўляюцца металы і неметалы, складаных — аксіды, кіслоты, асновы і солі. Іх састаў, уласцівасці і спосабы атрымання вы вывучалі раней. У дадзеным параграфе ўспомнім прынцыпы наменклатуры і класіфікацыі рэчываў (мал. 6).
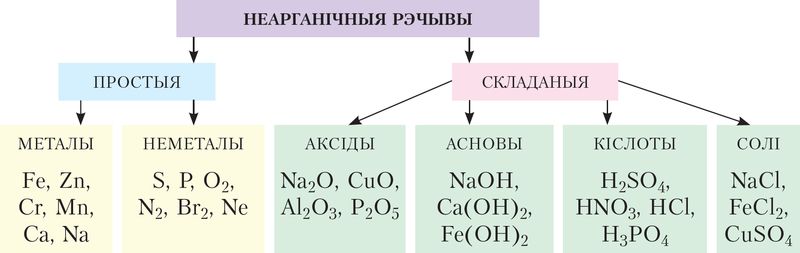
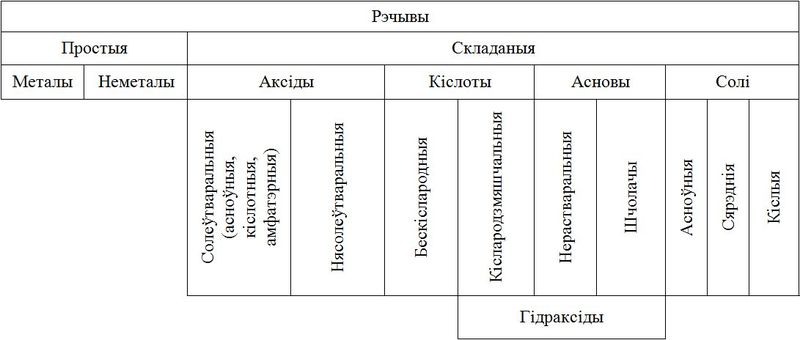
Неарганічныя рэчывы прынята дзяліць на класы (мал. 6.1). У кожным з класаў аб’ядноўваюць рэчывы, падобныя па саставе, будове, уласцівасцях. Паводле адной з агульнапрынятых класіфікацый, адрозніваюць простыя (металы і неметалы) і складаныя рэчывы. Найважнейшымі класамі складаных неарганічных рэчываў з’яўляюцца аксіды, кіслоты, асновы і солі. Як вам вядома, асновы і кіслародзмяшчальныя кіслоты маюць агульную назву — гідраксіды.
Металы — простыя цвёрдыя пры пакаёвай тэмпературы рэчывы (за выключэннем вадкай ртуці), якія валодаюць пластычнасцю і цеплаправоднасцю, высокай электраправоднасцю. Паліраваныя паверхні металаў заўсёды бліскучыя.
Неметалы — простыя цвёрдыя, вадкія ці газападобныя пры пакаёвай тэмпературы рэчывы. У цвёрдым стане, як правіла, непластычныя ці нават крохкія, дрэнна праводзяць цеплату і электрычны ток.
Аксіды — складаныя рэчывы, якія складаюцца з двух элементаў, адзін з якіх кісларод (ЭхОу).
Аксіды металаў пры нармальных умовах — цвёрдыя рэчывы. Аксіды неметалаў пры гэтых жа ўмовах могуць быць у цвёрдым, вадкім і газападобным станах.
Кісларод у аксідзе праяўляе ступень акіслення –2: (аксід вугляроду(IV)),
(аксід кальцыю).
Нагадаем: калі атамы элемента могуць існаваць у розных дадатных ступенях акіслення, гэтую ступень у назвах або формулах аксідаў, асноў, солей паказваюць рымскімі лічбамі. Іх ставяць у дужках пасля назвы адпаведнага элемента, напрыклад: аксід жалеза(III), гідраксід жалеза(II), хларыд жалеза(II).
Адрозніваюць солеўтваральныя (кіслотныя, амфатэрныя, асноўныя) і нясолеўтваральныя аксіды (мал. 7).
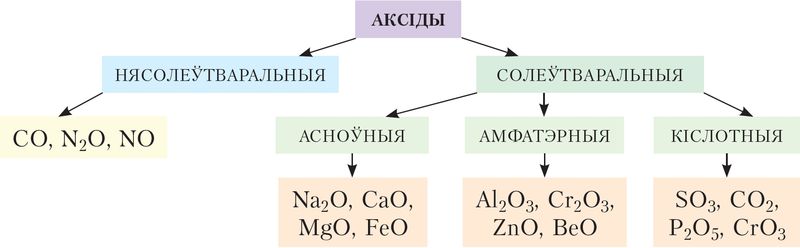
Да кіслотных адносяцца аксіды, якім адпавядаюць кіслоты. Кіслотныя аксіды рэагуюць са шчолачамі з утварэннем солі і вады:
Кіслотным аксідам адпавядаюць кіслародзмяшчальныя кіслоты: аксіду адпавядае кіслата
(ступені акіслення вугляроду аднолькавыя ў аксідзе і кіслаце).
Да асноўных адносяцца аксіды, якім адпавядаюць асновы. Асноўныя аксіды рэагуюць з кіслотамі з утварэннем солі і вады:
Асноўным аксідам адпавядаюць асновы. Напрыклад, аксіду адпавядае аснова
.
Амфатэрныя аксіды рэагуюць і з кіслотамі, і са шчолачамі:
(пры сплаўленні).
Рэакцыі амфатэрных аксідаў са шчолачамі могуць працякаць не толькі пры сплаўленні, але і ў растворы:
Злучэнне адносяць да класа комплексных злучэнняў. Дадатковыя звесткі аб такіх злучэннях прыведзены ў канцы дадзенага параграфа, а таксама ў матэрыяле пра ўласцівасці амфатэрных аксідаў і гідраксідаў у раздзеле II і металаў у раздзеле VII.
Да нясолеўтваральных аксідаў адносяць Пры пакаёвай тэмпературы яны не рэагуюць ні з кіслотамі, ні са шчолачамі.
Кіслотамі называюць складаныя рэчывы, якія змяшчаюць атам вадароду і кіслотныя астаткі, прычым атам вадароду здольны замяшчацца атамамі металаў.
Кіслоты таксама вызначаюць як электраліты, пры дысацыяцыі якіх у водных растворах у якасці катыёнаў утвараюцца толькі катыёны вадароду H+:
У табліцах 1 і 2 прыведзены састаў і дадзена класіфікацыя кіслот па розных прыкметах.
Табліца 1. Назвы некаторых кіслот і іх солей
| Бескіслародныя кіслоты | Кіслародзмяшчальныя кіслоты (гідраксіды) | ||||
| Хімічная формула | Назва кіслаты | Назва солі | Хімічная формула | Назва кіслаты | Назва солі |
| HI | Ёдавадародная | Ёдыд | HNO3 | Азотная | Нітрат |
| HBr | Бромавадародная | Брамід | HNO2 | Азоцістая | Нітрыт |
| HCl | Хлоравадародная | Хларыд | Н2SO4 | Серная | Сульфат |
| HF | Фторавадародная | Фтарыд | H2SO3 | Сярністая | Сульфіт |
| H2S | Серавадародная | Сульфід | H3PO4 | Фосфарная | Фосфат |
| H2CO3 | Вугальная | Карбанат | |||
| Н2SiO3 | Крэмніевая | Сілікат | |||
| НСlO4 | Хлорная | Перхларат | |||
Табліца 2. Класіфікацыя кіслот
| Прыкмета класіфікацыі | Класіфікацыйныя групы | Прыклады |
| Па паходжанні | Неарганічныя (мінеральныя) | НCl, H2SO4, HNO3 |
| Арганічныя (карбонавыя) | HCOOH, CH3COOH, C17H35COOH | |
| Па наяўнасці атамаў кіслароду | Кіслародзмяшчальныя | H3PO4, H2SO4, H2CO3 |
| Бескіслародныя | HCl, H2S, HF | |
| Па ліку атамаў вадароду, здольных замяшчацца атамамі металаў | Аднаасноўныя | HNO3, HF, НCl, CH3COOH |
| Многаасноўныя (двухасноўныя, трохасноўныя) | H2SO4, H2SO3, H2CO3, H3PO4 | |
| Па сіле (здольнасці дысацыіраваць на іоны ў водным растворы) | Моцныя | H2SO4, HNO3, НCl, HClO4 |
| Слабыя | H2S, H2SiO3, CH3COOH |
Асновы — складаныя рэчывы, якія складаюцца з атамаў металаў і гідраксагруп ОН: гідраксід натрыю NaOH, гідраксід жалеза(II) Fe(OH)2.
Асновы — гэта электраліты, пры дысацыяцыі якіх у якасці аніёнаў утвараюцца толькі гідраксід-іоны ОН–:
Усе асновы рэагуюць з кіслотамі, утвараючы соль і ваду (рэакцыя нейтралізацыі):
У аснове класіфікацыі асноў ляжаць наступныя прыкметы.
1. Лік груп ОН. Па ліку груп ОН, якiя прыпадаюць на адзін атам металу, адрозніваюць аднакіслотныя (NaOH, KOH, LiOH) і шматкіслотныя (Mg(OH)2, Ca(OH)2, Fe(OH)2) асновы.
2. Растваральнасць у вадзе. Гідраксіды металаў — цвёрдыя рэчывы. Водны раствор аміяку — гідрат аміяку (NH3 · H2O) — таксама валодае асноўнымі ўласцівасцямі і дысацыіруе з утварэннем гідраксід-іонаў. Для таго каб падкрэсліць гэтыя ўласцівасці, формулу гідрату аміяку часта запісваюць у звыклым для асноў выглядзе — NH4OH. Па растваральнасці ў вадзе неарганічныя асновы дзеляць на растваральныя (шчолачы) і нерастваральныя.
Шчолачы — гэта растваральныя ў вадзе асновы. Да шчолачаў адносяць растваральныя гідраксіды ўсіх элементаў IА-групы і шчолачназямельных металаў: стронцыю, барыю, радыю, уключаючы маларастваральны гідраксід кальцыю.
Амфатэрныя гідраксіды Zn(OH)2, Be(OH)2, Al(OH)3, як і адпаведныя ім аксіды, рэагуюць як з кіслотамі, так і са шчолачамі. Узаемадзеянне са шчолачамі магчыма ў расплавах і растворах:
(раствор);
(раствор).
Солі — гэта складаныя рэчывы, якія складаюцца з атамаў металаў і кіслотных астаткаў.
З пункту гледжання тэорыі электралітычнай дысацыяцыі солямі называюць складаныя рэчывы, пры дысацыяцыі якiх утвараюцца катыёны металаў і аніёны кіслотных астаткаў:
Да солей адносяць таксама злучэнні, якія змяшчаюць іон амонію і кіслотны астатак (хларыд амонію NH4Cl, сульфат амонію (NH4)2SO4 і інш.)
У аснове сістэматычных назваў солей ляжыць назва кіслотнага астатку і металу з указаннем у дужках рымскімі лічбамі ступені акіслення атамаў металу, калі яны могуць мець розныя значэнні. Напрыклад, MgSO4 — сульфат магнію, FeCl2 — хларыд жалеза(II), Fe2(SO4)3 — сульфат жалеза(III).
У залежнасці ад паўнаты замяшчэння атамаў вадароду ў кіслотах адрозніваюць сярэднія і кіслыя солі.
Кіслыя солі могуць утвараць шматасноўныя кіслоты (Н2SO4, Н2СO3, Н2S, Н3РO4) пры частковым замяшчэнні атамаў вадароду ў іх малекулах. Наяўнасць у саставе кіслай солі атамаў вадароду адлюстроўваецца ў назве, напрыклад NaHCO3 — гідракарбанат натрыю (пітная сода), Са(НСО3)2 — гідракарбанат кальцыю, NaH2PO4 — дыгідрафасфат натрыю, NaHSO4 — гідраcульфат натрыю.
На наступнай схеме паказана магчымасць поўнага і няпоўнага замяшчэння.

Пры няпоўным замяшчэнні гідраксагруп у аснове на кіслотныя астаткі ўтвараюцца асноўныя солі. У якасці прыкладу асноўных солей можна прывесці Al(OH)2NO3. Гэтую соль можна разглядаць як прадукт замяшчэння адной групы ОН у аснове Al(OH)3 на кіслотны астатак .
Асобную групу солей утвараюць так званыя комплексныя злучэнні. У курсе хіміі 11-га класа вы сустрэнецеся з некаторымі з такіх злучэнняў: Na2[Zn(OH)4] — тэтрагідраксацынкат натрыю, K3[Al(OH)6] — гексагідраксаалюмінат калію. Яны ўтрымліваюць комплексныя іоны, якія ў хімічных формулах бяруцца ў квадратныя дужкі.
Солі, у састаў якіх уваходзяць малекулы вады, называюць крышталегідратамі, а ваду — крышталізацыйнай: FeSO4 · 7H2O (жалезны купарвас, або гептагідрат сульфату жалеза(II)), Na2SO4 · 10H2O (глаўберава соль, або дэкагідрат сульфату натрыю).
З курса арганічнай хіміі вам вядомыя солі карбонавых кіслот (ацэтат натрыю СН3СООNa, стэарат калію C17H35COOK) і солі амінаў (хларыд метыламонію СН3NH3Cl, гідрасульфат феніламонію С6Н5NH3HSO4).