§ 3.5. Узаемасувязь паміж класамі неарганічных злучэнняў
Разнастайнасць неарганічных злучэнняў найбольш лагічна адлюстроўваюць так званыя генетычныя рады, што ўтрымліваюць злучэнні аднаго элемента, якія належаць розным класам. Як правіла, такі рад прадстаўлены элементам, яго аксідам, гідраксідам і адпаведнай соллю. Напрыклад, генетычны рад тыповага металу і генетычны рад неметалу выглядаюць так:
| Метал | → | асноўны аксід | → | гідраксід (аснова) | → | соль |
| Са | → | СаО | → | Са(ОН)2 | → | Са(NO3)2 |
| Неметал | → | кіслотны аксід | → | гідраксід (кіслата) | → | соль |
| S | → | SO2 | → | Н2SO3 | → | Na2SO3 |
Стрэлка (→) у дадзеных схемах азначае «адпавядае». Так, тыповаму металу адпавядаюць асноўны аксід, гідраксід, соль, у прыватнасці Са — аксід СаО, гідраксід Са(ОН)2, соль Са(NO3)2.
Уласцівасці злучэнняў металаў і неметалаў па сваёй сутнасці процілеглыя, таму рэчывы розных генетычных радоў могуць узаемадзейнічаць адно з адным, утвараючы пераважна солі. Некаторыя варыянты такіх парных узаемадзеянняў могуць быць паказаны схемамі на аснове генетычных радоў, з якіх відаць, што прадуктамі ўзаемадзеяння рэчываў розных генетычных радоў з’яўляюцца, галоўным чынам, солі (мал. 6.5, 6.6).
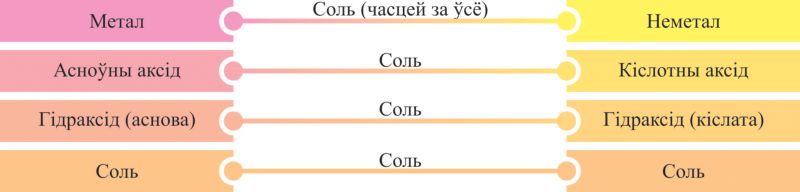
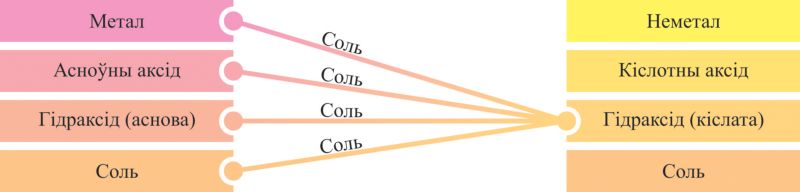
Пры ўзаемадзеянні металаў і неметалаў утвараюцца як солі (галагеніды, сульфіды — NaCl, Al2S3), так і бінарныя злучэнні, якія не адносяцца да класа солей (нітрыды, фасфіды, карбіды, гідрыды, аксіды — Li3N, Ca3P2, Al4C3, NaH, CaO).
Генетычныя рады ў арганічнай хіміі ўтвараюць злучэнні, якія ўтрымліваюць аднолькавы лік атамаў вугляроду:
С3Н8 → С3Н7Сl → С3Н7ОН → C2H5СНО → C2H5СОOH → CH3CH(Cl)СОOH → CH3CH(NH2)СОOH → NH—CH(CH3)CO
Веданне асаблівасцей кожнага віду ўзаемадзеянняў неабходна пры выкананні розных заданняў і рашэнні эксперыментальных задач. У практычнай дзейнасці хімікі атрымліваюць новыя рэчывы з наяўных у іх распараджэнні: напрыклад, серную кіслату — з сернага калчадану, аміяк — з азоту, азотную кіслату — з аміяку, цынк — з цынкавай падманкі і г. д. Пры гэтым, як правіла, неабходна правесці серыю рэакцый, каб атрымаць патрэбны прадукт. Напрыклад, адзін з варыянтаў атрымання цынку з прыроднага мінералу ZnS можна паказаць схемай ператварэнняў:
ZnS → ZnO → Zn,
для ажыццяўлення якіх неабходны рэакцыі:
1) акіслення сульфіду цынку кіслародам (абпал):
2ZnS + 3O2 = 2ZnO + 2SO2;
2) аднаўлення металу з аксіду:
ZnO + С = СО + Zn.
На выбар шляху ператварэнняў і распрацоўку тэхналагічных працэсаў уплываюць веданне ўласцівасцей рэчываў, улік даступнасці рэагентаў, бяспекі працэсаў і многія іншыя фактары.
У якасці прыкладу разгледзім ператварэнне рэчываў аднаго генетычнага раду — асноўнага аксіду ў гідраксід.
Прыклад 1. Складзіце ўраўненне рэакцыі, якая дазваляе атрымаць шчолач з асноўнага аксіду: СаО → Са(ОН)2.
Рашэнне
Паколькі кальцый — актыўны метал, то яго аксід рэагуе з вадой, утвараючы шчолач:
CaO + H2O = Ca(OH)2 (узаемадзеянне актыўнага металу з вадой).
Прыклад 2. Складзіце ўраўненні рэакцый, якія дазваляюць атрымаць нерастваральную аснову з асноўнага аксіду: FeO → Fe(OH)2.
Рашэнне
Паколькі Fe(OH)2 — нерастваральная аснова, то яе можна атрымаць толькі з раствору солі. Значыць, зыходны аксід FeO неабходна першапачаткова перавесці ў растваральную соль:
FeO + Н2SO4 = FeSO4 + H2O (растварэнне аксіду ў кіслаце, атрыманне растваральнай солі
Потым да раствору солі неабходна дадаць раствор шчолачы:
FeSO4 + 2NaOH → Fe(OH)2↓ + NaSO4 (атрыманне нерастваральнай асновы ўзаемадзеяннем раствораў солі і шчолачы).
Такім чынам, выбар рэагентаў залежыць ад таго, чым з’яўляецца прадукт ператварэння — гідраксід металу: шчолаччу або нерастваральнай асновай. Для атрымання шчолачы з аксіду дастаткова мець ваду, а нерастваральную аснову можна атрымаць толькі з раствору солі. Таму аксід неабходна папярэдне ператварыць у растваральную соль, а потым дадаць раствор шчолачы.