§ 36. Элементы VА-групы. Азот і фосфар
Азот як простае рэчыва
Азот як простае рэчыва складаецца з двухатамных малекул N2, графічная формула малекулы азоту . Атамы азоту звязаныя паміж сабой трыма кавалентнымі непалярнымі сувязямі, прычым адна з іх — σ-сувязь і дзве π-сувязі (мал. 87).
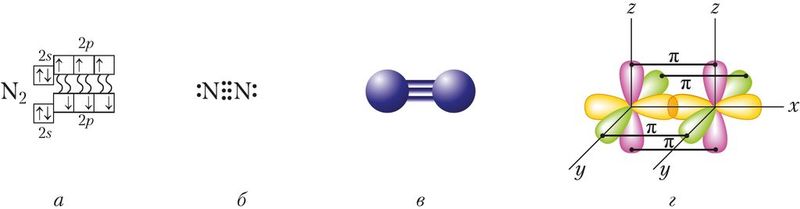
Энергія сувязі ў малекуле азоту вельмі высокая і складае 945 кДж/моль (для параўнання: О2 — 494 кДж/моль, Cl2 — 243 кДж/моль), што сведчыць пра трываласць сувязей, а значыць, і вялікую хімічную інертнасць рэчыва. Сапраўды, у пераважнай большасці рэакцыі з удзелам азоту працякаюць у «жорсткіх умовах» (пры вельмі высокіх тэмпературах і цісках).
Фізічныя ўласцівасці. Невялікае значэнне адноснай малекулярнай масы (Мr(N2) = 28) і адсутнасць палярнасці ў малекул азоту вызначаюць нізкія тэмпературы кіпення і плаўлення –196 °С і –210 °С. Азот — газ (н. у.) без колеру і паху, амаль не раствараецца ў вадзе.
Хімічныя ўласцівасці. Азот у рэакцыях з кіслародам і фторам праяўляе ўласцівасці адноўніку, а з металамі і вадародам — акісляльніку.
1. Азот як адноўнік. Рэакцыя азоту з кіслародам працякае пры тэмпературы каля 3000 °С — у электрычнай дузе або разрадзе маланкі. Рэакцыя з’яўляецца эндатэрмічнай. Пры гэтым утвараецца аксід азоту(II):
2. Азот як акісляльнік. Рэакцыя азоту з вадародам працякае пры высокай тэмпературы і ціску нават у прысутнасці каталізатараў:
Рэагуючы з металамі (пры павышанай тэмпературы), азот утварае бінарныя злучэнні нітрыды:
(нітрыд магнію).
З літыем азот уступае ў рэакцыю без награвання:
(нітрыд літыю).
Нітрыды лёгка раскладаюцца вадой, утвараючы аміяк і гідраксіды металаў:
Азот атрымліваюць у прамысловых маштабах са звадкаванага паветра, у лабараторыі ў невялікіх колькасцях — раскладаннем нітрыту амонію:
Выкарыстанне. Асноўная сфера прымянення азоту — вытворчасць аміяку. Яго выкарыстоўваюць таксама для стварэння інертнага асяроддзя пры захоўванні харчовых прадуктаў, твораў мастацтва і рукапісаў, у пажаратушэнні, лазерным рэзанні металаў. Пашыраецца спектр яго выкарыстання ў медыцыне і касметалогіі, напрыклад крыякансервацыя клетак, крыятэрапія (выдаленне папілом і гемангіём).