§ 36. Элементы VА-групы. Азот і фосфар
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 36. Элементы VА-групы. Азот і фосфар |
| Напечатано:: | Гость |
| Дата: | Понедельник, 11 Август 2025, 15:16 |
Азот і фосфар як хімічныя элементы
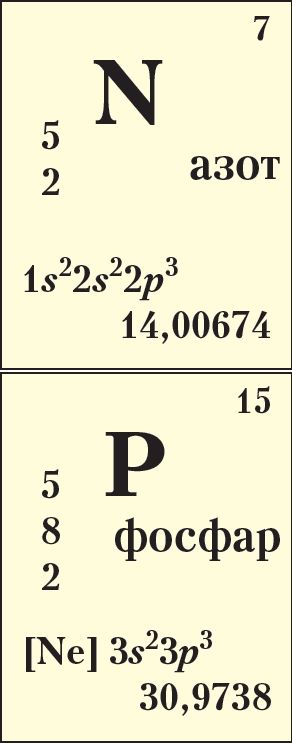
Элементы VА-групы азот 7N і фосфар 15P утвараюць простыя рэчывы, якія адносяцца да неметалаў. Да гэтай самай групы перыядычнай сістэмы адносяць мыш’як 33As, сурму 51Sb і вісмут 83Bi. На знешнім электронным слоі, агульная канфігурацыя якога ns2np3, іх атамы маюць па 5 электронаў, з якіх тры няспараныя на р-падузроўні:
Найніжэйшая ступень іх акіслення роўная –3, найвышэйшая +5, пры гэтым фосфар часцей за ўсё выяўляе дадатныя ступені акіслення +3 і +5, а азот утварае даволі ўстойлівыя злучэнні са ступенямі акіслення +1, +2, +3, +4
і +5. Азот — трэці паводле электраадмоўнасці элемент пасля кіслароду і фтору, а фосфар нязначна саступае вадароду (гл. § 11, табл. 7, с. 60).
Распаўсюджанасць азоту і фосфару ў прыродзе
Сярод элементаў VА-групы на Зямлі найбольш распаўсюджаны фосфар, яго масавая доля — 0,1 %. Азоту значна менш, але ён пераважае ў атмасферы — аб’ёмная доля 78 %, масавая — 75,5 %. З нешматлікіх мінералаў азоту найбольш значныя салетры: NaNO3 — натрыевая салетра і KNO3 — калійная салетра.
Фосфар на Зямлі сустракаецца выключна ў выглядзе злучэнняў і ўваходзіць у састаў фасфарытаў і апатытаў (іх асноўны кампанент — фасфат кальцыю Ca3(PO4)2), а таксама фторапатытаў Са5[РО4]3F.
Злучэнні азоту і фосфару важныя для жывых арганізмаў: азот як складовая частка амінакіслот і бялкоў, фосфар — нуклеінавых кіслот, АТФ (адэназінтрыфосфарнай кіслаты), ферментаў, касцявой сістэмы. Для чалавека дзённая патрэба ў фосфары досыць высокая — ад 1 г да 3,8 г у залежнасці ад узросту і фізіялагічнага стану арганізма. Пры нагрузках патрэба ўзрастае ў 1,5–2 разы. Найбольш багатыя на фосфар ядры насення гарбуза, сланечніку, а таксама какава, пячонка, рыба, цвёрдыя сыры і іншыя малочныя прадукты. Недахоп азоту і фосфару часта адчуваюць расліны. Для культур, якія вырошчваюцца, гэтая праблема вырашаецца ўнясеннем угнаенняў.
Азот як простае рэчыва
Азот як простае рэчыва складаецца з двухатамных малекул N2, графічная формула малекулы азоту . Атамы азоту звязаныя паміж сабой трыма кавалентнымі непалярнымі сувязямі, прычым адна з іх — σ-сувязь і дзве π-сувязі (мал. 87).
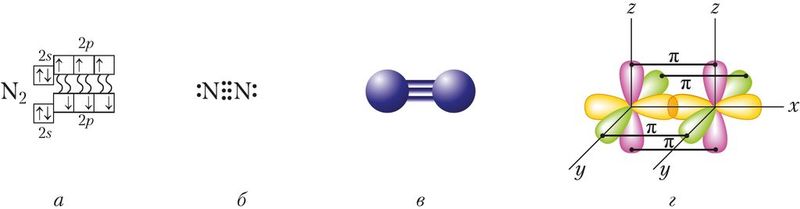
Энергія сувязі ў малекуле азоту вельмі высокая і складае 945 кДж/моль (для параўнання: О2 — 494 кДж/моль, Cl2 — 243 кДж/моль), што сведчыць пра трываласць сувязей, а значыць, і вялікую хімічную інертнасць рэчыва. Сапраўды, у пераважнай большасці рэакцыі з удзелам азоту працякаюць у «жорсткіх умовах» (пры вельмі высокіх тэмпературах і цісках).
Фізічныя ўласцівасці. Невялікае значэнне адноснай малекулярнай масы (Мr(N2) = 28) і адсутнасць палярнасці ў малекул азоту вызначаюць нізкія тэмпературы кіпення і плаўлення –196 °С і –210 °С. Азот — газ (н. у.) без колеру і паху, амаль не раствараецца ў вадзе.
Хімічныя ўласцівасці. Азот у рэакцыях з кіслародам і фторам праяўляе ўласцівасці адноўніку, а з металамі і вадародам — акісляльніку.
1. Азот як адноўнік. Рэакцыя азоту з кіслародам працякае пры тэмпературы каля 3000 °С — у электрычнай дузе або разрадзе маланкі. Рэакцыя з’яўляецца эндатэрмічнай. Пры гэтым утвараецца аксід азоту(II):
2. Азот як акісляльнік. Рэакцыя азоту з вадародам працякае пры высокай тэмпературы і ціску нават у прысутнасці каталізатараў:
Рэагуючы з металамі (пры павышанай тэмпературы), азот утварае бінарныя злучэнні нітрыды:
(нітрыд магнію).
З літыем азот уступае ў рэакцыю без награвання:
(нітрыд літыю).
Нітрыды лёгка раскладаюцца вадой, утвараючы аміяк і гідраксіды металаў:
Азот атрымліваюць у прамысловых маштабах са звадкаванага паветра, у лабараторыі ў невялікіх колькасцях — раскладаннем нітрыту амонію:
Выкарыстанне. Асноўная сфера прымянення азоту — вытворчасць аміяку. Яго выкарыстоўваюць таксама для стварэння інертнага асяроддзя пры захоўванні харчовых прадуктаў, твораў мастацтва і рукапісаў, у пажаратушэнні, лазерным рэзанні металаў. Пашыраецца спектр яго выкарыстання ў медыцыне і касметалогіі, напрыклад крыякансервацыя клетак, крыятэрапія (выдаленне папілом і гемангіём).
Фосфар як простае рэчыва
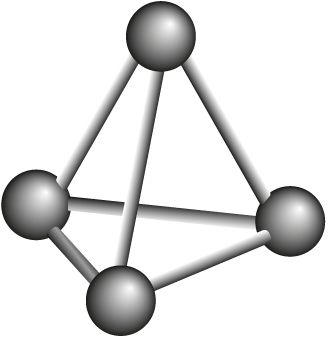
Фосфар, з’яўляючыся элементам VА-групы, як і азот, здольны ўтвараць малекулу саставу P2. Аднак, у адрозненне ад малекулы азоту, двухатамная малекула фосфару няўстойлівая. Таму фосфар існуе ў выглядзе некалькіх алатропных мадыфікацый, у якіх рэалізуюцца толькі адзінарныя сувязі Р—Р: фосфар белы, чырвоны, чорны і іншыя (табл. 29).
Табліца 29. Будова і фізічныя ўласцівасці алатропных мадыфікацый фосфару
| Алатропныя мадыфікацыі фосфару | Будова | Тэмпература плаўлення | Тэмпература кіпення |
|
Р4 фосфар белы  |
 |
44 °С | 281 °С |
|
Р фосфар чырвоны  |
 |
260 °С | ‒ Узганяецца пры тэмпературы каля 400 °С |
|
* Р фосфар чорны  |
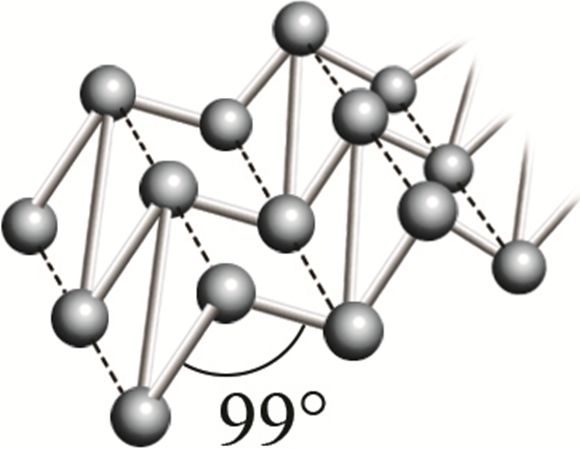
Фрагмент крышталічнай рашоткі чорнага фосфару |
Пры награванні (атмасферны ціск) ператвараецца ў чырвоны фосфар | 1000 °С (пры 1,8 ∙ 106 атм) |

Фізічныя ўласцівасці. Белы фосфар Р4 уяўляе сабой воскападобнае рэчыва з часночным пахам, атрутны. На паветры ў цемры свеціцца зеленавата-жоўтым колерам у выніку павольнай хімічнай рэакцыі акіслення (хемілюмінесцэнцыя (мал. 88)).
Чырвоны фосфар — аморфнае рэчыва палімернай будовы, не мае паху, яго таксічнасць невысокая.
Паміж алатропнымі мадыфікацыямі фосфару магчымыя ўзаемаператварэнні, якія праходзяць пры пэўных тэмпературах і цісках.
Хімічныя ўласцівасці. Як акісляльнік фосфар пры награванні ўступае ў рэакцыі з металамі, утвараючы фасфіды:
З вадародам фосфар не рэагуе.
Як адноўнік фосфар рэагуе з кіслародам і іншымі моцнымі акісляльнікамі. У чыстым кіслародзе і на паветры фосфар асляпляльна гарыць, утвараючы белы дым (часціцы цвёрдых аксідаў фосфару):
(аксід фосфару(V) у лішку кіслароду);
(аксід фосфару(III) пры нястачы кіслароду).
Белы фосфар можа самазагарацца на паветры, а чырвоны загараецца толькі пры падпальванні, што тлумачыцца рознай трываласцю хімічных сувязей паміж атамамі фосфару ў алатропных мадыфікацыях.
Фосфар атрымліваюць напальваннем сумесі фасфату кальцыю з пяском і вугалем:
Не рэагуючы з вадародам непасрэдна, фосфар, тым не менш, утварае вадародныя злучэнні. Так, фасфін можна атрымаць ускосна, напрыклад, з фасфідаў, якія разбураюцца як вадой, так і кіслотамі: Mg3Р2 + 6H2O = 3Mg(ОН)2↓ + 2РH3↑.
Фасфін РH3 — газ з часночным пахам.
У прыродзе вадародныя злучэнні фосфару сустракаюцца там, дзе адбываецца інтэнсіўнае раскладанне бялковых рэчываў.
Прымяненне. Белы фосфар выкарыстоўваюць для вытворчасці фосфарных кіслот і іх вытворных, у металургіі як кампанент некаторых гарачатрывалых сплаваў. Чырвоны фосфар выкарыстоўваюць у вытворчасці запалак, у арганічным сінтэзе (лекавыя прэпараты, ядахімікаты). Узоры фосфару, якія ўтрымліваюць нуклід 32Р («значаны атам») з перыядам паўраспаду 14,22 дзён, выкарыстоўваюць у даследчых працах.
Найніжэйшая ступень акіслення азоту і фосфару –3, найвышэйшая +5.
Інертнасць простага рэчыва азот абумоўлена наяўнасцю трайной сувязі ў малекуле N2.
Фосфар існуе ў выглядзе некалькіх алатропных мадыфікацый: белы, чырвоны і іншыя.
Азот і фосфар выяўляюць як аднаўленчыя, так і акісляльныя ўласцівасці. Фосфар не рэагуе з вадародам.
Пытанні, заданні, задачы
1. Назавіце:
- а) формулу простага рэчыва азот;
- б) формулу белага фосфару;
- в) найніжэйшую ступень акіслення азоту;
- г) найвышэйшую ступень акіслення фосфару;
- д) асаблівасці паху белага фосфару;
- е) алатропныя мадыфікацыі фосфару, які выкарыстоўваецца ў вытворчасці запалак;
- ё) прыродныя злучэнні фосфару;
- ж) хімічныя формулы каліевай салетры, натрыевай салетры;
- з) утрыманне азоту ў паветры.
2. Запішыце сімвалы элементаў VA-групы і агульную формулу іх электроннай канфігурацыі.
3. Ахарактарызуйце электронную будову атама азоту і фосфару.
4. Апішыце фізічныя ўласцівасці азоту і алатропных мадыфікацый фосфару.
5. Запоўніце табліцу для рэагентаў кісларод, вадарод, літый, магній (запішыце ў сваім сшытку адпаведныя ўраўненні магчымых рэакцый).
| Рэагент | N2 | P |
Зрабіце высновы пра падабенства і адрозненне ўласцівасцей азоту і фосфару.
6. Пры ўзаемадзеянні кальцыю масай 0,9 г з азотам атрымана злучэнне масай 1,11 г. Вызначце хімічную формулу злучэння.
7. Фосфар акісляецца хлорам, азотнай і сернай кіслотамі. Расстаўце каэфіцыенты метадам электроннага балансу ў схемах гэтых рэакцый:
- а) Р + Сl2 → PCl5;
- б) Р + КСlO3 → P2O5 + KCl;
- в) Р + HNO3(разб) + H2О → H3PO4 + NO;
- г) Р + H2SO4(канц) → H3PO4 + SO2 + H2О.
8. Разлічыце масу белага фосфару, які можна атрымаць пры напальванні з пяском і вугалем фасфарыту, які ўтрымлівае фасфат кальцыю масай 6,2 т, калі выхад прадукту складае 92 %. Рэакцыя працякае паводле ўраўнення на с. 201.
9. Як паўплывае павышэнне тэмпературы і ціску на зрушванне раўнавагі ў рэакцыях:
- а)
;
- б)
?
10. У закрытую пасудзіну змясцілі вадарод хімічнай колькасцю 6 моль і азот колькасцю 4 моль і нагрэлі да 450 °С у прысутнасці каталізатару. Вызначце аб’ёмную долю аміяку ў канчатковай сумесі, калі доля азоту, які ўступіў у рэакцыю, роўная 15 %.
*Самакантроль
1. Трайную сувязь мае малекула:
- а) Н2;
- б) N2;
- в) Р4;
- г) О2.
2. Фосфар як элемент характарызуюць сцвярджэнні:
- а) уваходзіць у састаў касцяной тканкі пераважна ў выглядзе фасфату кальцыю;
- б) найвышэйшая ступень акіслення роўная +5;
- в) чырвоны фосфар з’яўляецца кампанентам пакрыцця на запалкавых пачках;
- г) белы фосфар мае малекулярную будову.
3. Фосфар не рэагуе нават пры награванні з:
- а) Мg;
- б) Zn;
- в) О2;
- г) Н2.
4. Азот мае дадатную ступень акіслення ў злучэннях:
- а) NO;
- б) NaNO3;
- в) КNO3;
- г) Na3N.
5. Фосфар выступае ў ролі акісляльніку, рэагуючы з:
- а) Na;
- б) Zn;
- в) Са;
- г) Cl2.