§ 22. Хімічная раўнавага
Хімічныя ўласцівасці рэчываў вы ў большасці выпадкаў вывучалі на прыкладзе неабарачальных рэакцый, гэта значыць ператварэнняў, якія працякаюць у вызначанных умовах толькі ў адным кірунку. Такія рэакцыі заканчваюцца, калі хаця б адзін з рэагентаў цалкам ператвараецца ў прадукт. Калі рэагенты ўзяты ў стэхіяметрычных суадносінах, то рэакцыя заканчваецца пры поўным ператварэнні ўсіх зыходных рэчываў.
Вывучыўшы матэрыял § 18, вы даведаліся, што існуе мноства абарачальных рэакцый, якія ў пэўных умовах правядзення працякаюць як у прамым, так і ў зваротным напрамках адначасова. У выніку рэакцыі працякаюць не «да канца», а да стану раўнавагі. Пры змяненні ўмоў працякання абарачальнай рэакцыі яе звычайна можна правесці пераважна ў прамым або зваротным напрамку.
У якасці прыкладу разгледзім абарачальную рэакцыю сінтэзу ёдавадароду з газападобных простых рэчываў пры тэмпературы 450 °С:
У пачатку рэакцыі ў пасудзіне знаходзяцца толькі вадарод H2 і ёд I2.
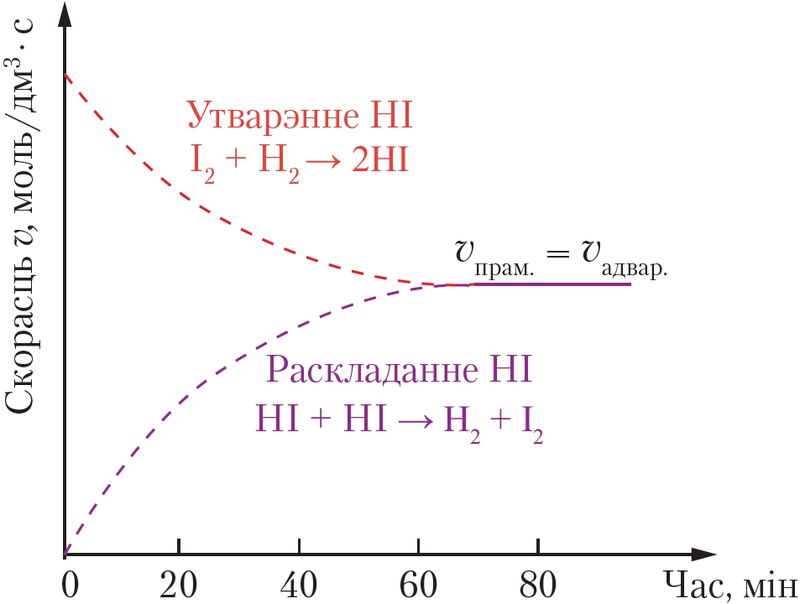
У ходзе рэакцыі іх колькасць паступова памяншаецца. З прычыны гэтага скорасць прамой рэакцыі ўтварэння HI таксама памяншаецца (мал. 49).
Адначасова павялічваецца колькасць ёдавадароду, у выніку чаго скорасць зваротнай рэакцыі (раскладання HI) паступова павялічваецца. Праз нейкі час скорасць і прамой, і зваротнай рэакцый становяцца аднолькавымі і больш не змяняюцца: υпрам. = υадвар..
Такі стан завецца рухомай хімічнай раўнавагай, ці проста хімічнай раўнавагай.
Хімічная раўнавага — гэта ўстойлівы стан рэакцыйнай сумесі, пры якім прамая і зваротная рэакцыі працякаюць з аднолькавай скорасцю. У стане раўнавагі канцэнтрацыі рэагентаў і прадуктаў рэакцыі не змяняюцца з часам і называюцца збалансаванымі.
Хімічная раўнавага ўстанаўліваецца незалежна ад таго, як ажыццяўляецца працэс — злева направа ці справа налева. Калі ў рэактар змясціць ёдавадарод замест сумесі H2 і I2 і нагрэць яго да 450 °С, то праз нейкі час скорасць рэакцыі раскладання HI зраўняецца са скорасцю рэакцыі сінтэзу HI. Атрымаецца раўнаважная сумесь з такімі ж суадносінамі колькасцей H2, I2 і HI, як у выпадку, калі б у якасці зыходных рэчываў рэагентаў была ўзята сумесь роўных колькасцей H2 і I2.