§ 22. Хімічная раўнавага
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 22. Хімічная раўнавага |
| Напечатано:: | Гость |
| Дата: | Пятница, 27 Июнь 2025, 03:25 |
Хімічныя ўласцівасці рэчываў вы ў большасці выпадкаў вывучалі на прыкладзе неабарачальных рэакцый, гэта значыць ператварэнняў, якія працякаюць у вызначанных умовах толькі ў адным кірунку. Такія рэакцыі заканчваюцца, калі хаця б адзін з рэагентаў цалкам ператвараецца ў прадукт. Калі рэагенты ўзяты ў стэхіяметрычных суадносінах, то рэакцыя заканчваецца пры поўным ператварэнні ўсіх зыходных рэчываў.
Вывучыўшы матэрыял § 18, вы даведаліся, што існуе мноства абарачальных рэакцый, якія ў пэўных умовах правядзення працякаюць як у прамым, так і ў зваротным напрамках адначасова. У выніку рэакцыі працякаюць не «да канца», а да стану раўнавагі. Пры змяненні ўмоў працякання абарачальнай рэакцыі яе звычайна можна правесці пераважна ў прамым або зваротным напрамку.
У якасці прыкладу разгледзім абарачальную рэакцыю сінтэзу ёдавадароду з газападобных простых рэчываў пры тэмпературы 450 °С:
У пачатку рэакцыі ў пасудзіне знаходзяцца толькі вадарод H2 і ёд I2.
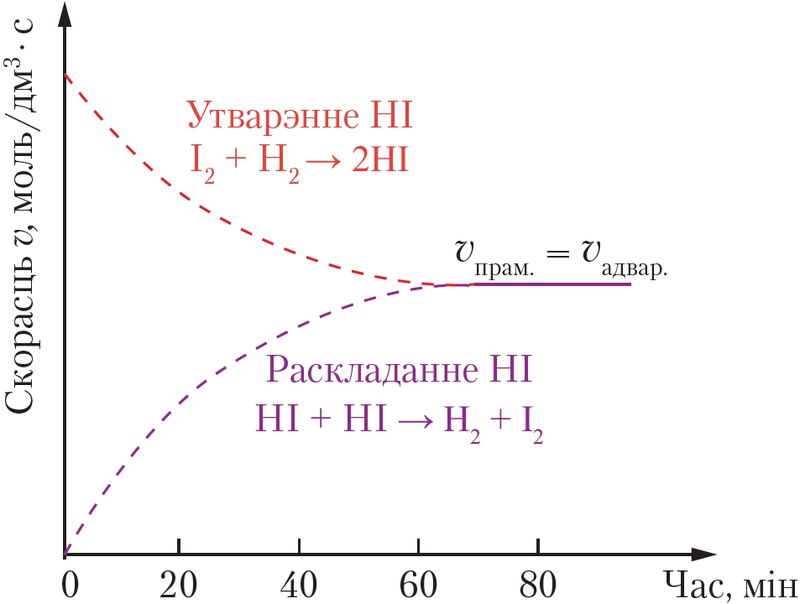
У ходзе рэакцыі іх колькасць паступова памяншаецца. З прычыны гэтага скорасць прамой рэакцыі ўтварэння HI таксама памяншаецца (мал. 49).
Адначасова павялічваецца колькасць ёдавадароду, у выніку чаго скорасць зваротнай рэакцыі (раскладання HI) паступова павялічваецца. Праз нейкі час скорасць і прамой, і зваротнай рэакцый становяцца аднолькавымі і больш не змяняюцца: υпрам. = υадвар..
Такі стан завецца рухомай хімічнай раўнавагай, ці проста хімічнай раўнавагай.
Хімічная раўнавага — гэта ўстойлівы стан рэакцыйнай сумесі, пры якім прамая і зваротная рэакцыі працякаюць з аднолькавай скорасцю. У стане раўнавагі канцэнтрацыі рэагентаў і прадуктаў рэакцыі не змяняюцца з часам і называюцца збалансаванымі.
Хімічная раўнавага ўстанаўліваецца незалежна ад таго, як ажыццяўляецца працэс — злева направа ці справа налева. Калі ў рэактар змясціць ёдавадарод замест сумесі H2 і I2 і нагрэць яго да 450 °С, то праз нейкі час скорасць рэакцыі раскладання HI зраўняецца са скорасцю рэакцыі сінтэзу HI. Атрымаецца раўнаважная сумесь з такімі ж суадносінамі колькасцей H2, I2 і HI, як у выпадку, калі б у якасці зыходных рэчываў рэагентаў была ўзята сумесь роўных колькасцей H2 і I2.
Зрушванне хімічнай раўнавагі. Прынцып Ле Шатэлье
Такім чынам, у раўнаважным стане суадносіны колькасцей рэагентаў і прадуктаў для дадзенай рэакцыі і ў зададзеных умовах цалкам вызначаны і могуць захоўвацца бясконца доўга. Для змянення гэтых суадносін, напрыклад з мэтай павышэння выхаду прадукту, неабходна стварыць новыя ўмовы абарачальнай рэакцыі.
Зрушванне хімічнай раўнавагі — гэта працэс устанаўлення новага стану раўнавагі абарачальнай рэакцыі пры змяненні ўмоў яе працякання.
Калі пасля змянення ўмоў правядзення абарачальнай рэакцыі скорасць прамой рэакцыі становіцца большай за скорасць зваротнай рэакцыі, то раўнавага зрушваецца ўправа: раўнаважныя канцэнтрацыі прадуктаў рэакцыі павялічваюцца, а зыходных рэчываў — памяншаюцца.
Калі пасля змянення ўмоў з большай скорасцю пачынае працякаць зваротная рэакцыя, то раўнавага абарачальнай рэакцыі зрушваецца ўлева: раўнаважныя канцэнтрацыі зыходных рэчываў павялічваюцца, а прадуктаў рэакцыі — памяншаюцца.
Дасягненне рэакцыйнай сумессю новага стану раўнавагі займае нейкі час. Новая хімічная раўнавага характарызуецца ўжо іншымі раўнаважнымі канцэнтрацыямі ўдзельнікаў рэакцыі.
Напрамак зрушвання хімічнай раўнавагі пры змяненні ўмоў працякання рэакцыі вызначаецца прынцыпам Ле Шатэлье, устаноўленым французскім вучоным А. Л. Ле Шатэлье ў 1884 годзе.
Калі на сістэму, што знаходзіцца ў раўнавазе, аказаць знешняе ўздзеянне (змяніць тэмпературу, ціск або канцэнтрацыю), то раўнавага зрушваецца ў напрамку той рэакцыі (прамой або зваротнай), якая аслабляе аказанае ўздзеянне.
Незалежна ад А. Л. Ле Шатэлье прынцып хімічнай раўнавагі ў абарачальных рэакцыях у 1887 годзе сфармуляваў і тэарэтычна абгрунтаваў нямецкі фізік К. Ф. Браўн. Гэты прынцып выкарыстоўваецца ў дачыненні да абарачальных рэакцый у газах, а таксама да рэакцый у растворах або да гетэрагенных рэакцый з удзелам цвёрдых і газападобных рэчываў.
Уплыў тэмпературы
З тэрмахімічных ураўненняў, запісаных у выглядзе:
вынікае, што прамая рэакцыя сінтэзу HI ідзе з вылучэннем цеплаты, а зваротная — з паглынаннем такой ж колькасці цеплаты.
Пры павышэнні тэмпературы хімічная раўнавага зрушваецца ў напрамку эндатэрмічнай рэакцыі, пры паніжэнні — у напрамку экзатэрмічнай.
Пры павышэнні тэмпературы ў раўнаважнай сістэме ў большай ступені павялічваецца скорасць рэакцыі распаду HI з паглынаннем цеплаты. Так аслабляецца награванне і памяншаецца колькасць падведзенай цеплаты (табл. 15).
Табліца 15. Раўнаважнае ўтрыманне HI(г) у сумесі з зыходнымі колькасцямі H2(г) і I2(г)
| Тэмпература, °С | 100 | 200 | 300 | 400 | 500 | 600 | 700 |
| Утрыманне HI, % | 90 | 86 | 83 | 81 | 79 | 76 | 73 |
Уплыў ціску ў сістэме
Пры пастаянных тэмпературы і аб’ёме ціск у сістэме прама прапарцыянальны агульнай колькасці газаў у сумесі. Калі ў ходзе хімічнай рэакцыі колькасць (моль) газаў у сістэме павялічваецца, то ціск узрастае. На прыкладзе абарачальнай рэакцыі сінтэзу аміяку:
разгледзім змяненне колькасці газаў у ходзе хімічнага ператварэння. З ураўнення рэакцыі вынікае, што:
- а) у выніку прамой рэакцыі сінтэзу аміяку агульная колькасць газаў памяншаецца з 4 да 2 моль, з прычыны чаго ціск у сістэме паніжаецца;
- б) у выніку зваротнай рэакцыі раскладання аміяку агульная колькасць газаў павялічваецца з 2 да 4 моль, з прычыны чаго ціск у сістэме ўзрастае.
Калі павялічыць ціск у сістэме, раўнавага зрушыцца ў бок яго паніжэння, гэта значыць памяншэння колькасці газаў пры працяканні рэакцыі ў прамым напрамку. Наадварот, пры памяншэнні ціску раўнавага зрушыцца ў зваротным напрамку для павелічэння колькасці газаў за кошт раскладання аміяку.
Калі аб’ём сістэмы можна змяніць, то павелічэнне ціску шляхам сціскання газаў прывядзе да памяншэння іх аб’ёму і зрушвання раўнавагі ў бок працякання прамой рэакцыі — узаемадзеяння азоту і вадароду.
Вядома даволі многа абарачальных рэакцый, падчас якіх агульная колькасць газаў не змяняецца. Напрыклад:
Відавочна, што ў такіх выпадках змяненне аб’ёму сістэмы або агульнага ціску газападобных рэагентаў і прадуктаў рэакцыі ў ёй не ўплывае на стан хімічнай раўнавагі.
Уплыў канцэнтрацыі рэчываў
Хімічную раўнавагу можна зрушыць, змяняючы канцэнтрацыю рэчываў, якія ўдзельнічаюць у рэакцыі. У сістэме пастаяннага аб’ёму павелічэнне канцэнтрацыі аднаго з рэчываў раўназначнае яго дадаванню ў рэакцыйную сумесь, а памяншэнне канцэнтрацыі рэчыва раўназначнае яго выдаленню з рэактыўнай сумесі.
Разгледзім уплыў змянення канцэнтрацыі на стан раўнавагі рэакцыі: .
Пры павелічэнні канцэнтрацыі аднаго або абодвух зыходных рэчываў А і В скорасць прамой рэакцыі ўзрастае. Гэта прыводзіць да зрушвання раўнавагі ўправа і назапашвання прадуктаў рэакцыі (C і D).
Пры павелічэнні канцэнтрацыі аднаго або абодвух прадуктаў рэакцыі С і D скорасць зваротнай рэакцыі ўзрастае, што прыводзіць да зрушвання раўнавагі ўлева і назапашвання зыходных рэчываў А і В.
Пры павелічэнні канцэнтрацыі зыходных рэчываў хімічная раўнавага зрушваецца ўправа, а пры іх памяншэнні — улева.
Пры павелічэнні канцэнтрацыі прадуктаў рэакцыі хімічная раўнавага зрушваецца ўлева, а пры іх памяншэнні — управа.
Прыклад 1. Вызначце, у які бок зрушыцца хімічная раўнавага рэакцыі
- а) пры павелічэнні канцэнтрацыі азоту;
- б) пры памяншэнні канцэнтрацыі вадароду;
- в) пры памяншэнні канцэнтрацыі аміяку.
Аб’ём сістэмы пастаянны.
Рашэнне. Паколькі азот — зыходнае рэчыва, то пры павелічэнні яго канцэнтрацыі ўзрасце скорасць прамой рэакцыі, раўнавага зрушыцца ўправа, у бок утварэння NH3.
Паколькі вадарод — зыходнае рэчыва, то пры памяншэнні яго канцэнтрацыі скорасць прамой рэакцыі панізіцца, раўнавага зрушыцца ўлева.
Паколькі аміяк — гэта прадукт рэакцыі, то пры памяншэнні яго канцэнтрацыі скорасць зваротнай рэакцыі паменшыцца, раўнавага зрушыцца ўправа, у бок яго ўтварэння.
Уплыў каталізатара
Навошта ў раўнаважных рэакцыях выкарыстоўваюцца каталізатары?
Каталізатары адначасова павялічваюць скорасці прамой і зваротнай рэакцый, гэта значыць паскараюць набліжэнне раўнавагі.
Каталізатары не ўплываюць на становішча хімічнай раўнавагі, паколькі ў роўнай ступені паскараюць як прамую, так і зваротную рэакцыі.
Так, на малюнку 49 на с. 120 відаць, што без каталізатара стан раўнавагі пры 450 °С для рэакцыі сінтэзу HI дасягаецца на працягу гадзіны. Пры выкарыстанні каталізатара раўнавага ў гэтай рэакцыі дасягаецца за секунды нават пры тэмпературы каля 350 °С.
Калі на сістэму, якая знаходзіцца ў раўнавазе, аказаць знешняе ўздзеянне (змяніць тэмпературу, ціск ці канцэнтрацыю аднаго з рэчываў), то раўнавага зрушваецца ў напрамку той рэакцыі (прамой або зваротнай), якая аслабляе аказанае ўздзеянне.
Каталізатары паскараюць дасягненне хімічнай раўнавагі, але не ўплываюць на яе стан.
Пытанні, заданні, задачы
1. Напішыце ўраўненні трох абарачальных рэакцый.
2. Які стан рэакцыйнай сумесі называецца хімічнай раўнавагай?
3. Які працэс называецца зрушваннем хімічнай раўнавагі?
4. Сфармулюйце прынцып Ле Шатэлье.
5. Растлумачце сэнс выразу: «Хімічная раўнавага зрушылася ў бок прамой рэакцыі (управа)». Як пры гэтым змяніліся канцэнтрацыі рэагуючых рэчываў?
6. Як уплывае змяненне тэмпературы на стан раўнавагі, калі ў прамым напрамку працякае
- а) эндатэрмічная,
- б) экзатэрмічная хімічная рэакцыя?
7. Як уплывае памяншэнне аб’ёму сістэмы на стан раўнавагі рэакцый, пры працяканні якіх агульная колькасць (моль) газападобных прадуктаў павялічваецца?
8. У які бок зрушыцца хімічная раўнавага :
- а) пры ахалоджванні рэакцыйнай сумесі;
- б) пры павелічэнні канцэнтрацыі кіслароду;
- в) пры выкарыстанні каталізатара;
- г) пры павелічэнні ціску?
9. У які бок зрушыцца хімічная раўнавага ў сістэме :
- а) пры павелічэнні тэмпературы;
- б) пры павелічэнні аб’ёму сістэмы (памяншэнні ў ёй ціску);
- в) пры павелічэнні канцэнтрацыі чаднага газу?
10. У закрытую пасудзіну змясцілі сумесь SO2 і О2 з канцэнтрацыяй 0,04 і 0,03 моль/дм3 адпаведна. Пасля ўстанаўлення раўнавагі ў рэакцыйнай сумесі у пасудзіне ўтварыўся SO3, канцэнтрацыя якога — 0,025 моль/дм3. Вызначце раўнаважныя канцэнтрацыі SO2 і О2.
*Самакантроль
1. Для стану хімічнай раўнавагі справядлівыя сцвярджэнні:
- а) прамая і абарачальная рэакцыі працякаюць з роўнай скорасцю;
- б) канцэнтрацыі рэагентаў і прадуктаў роўныя;
- в) змяненне ўмоў працякання абарачальнай рэакцыі можа прывесці да новай раўнавагі;
- г) каталізатар уплывае на становішча хімічнай раўнавагі.
2. Павелічэнне тэмпературы прывядзе да зрушэння раўнавагі ў бок абарачальнай рэакцыі:
- a) Н2(г) + I2(г)
2HI(г) + Q;
- б) Fe2O3(цв) + 3H2(г)
2Fe(цв) + 3H2O(г) – Q;
- в) CO(г) + Cl2(г)
COCl2(г) + Q;
- г) 2NO(г) + O2(г)
2NO2(г) + Q.
3. Раўнавага зрушыцца пры павелічэнні ціску ў рэакцыі:
- a) СаО(цв) + СО2(г)
СаСО3(цв);
- б) Fe3O4(цв) + 4H2(г)
3Fe(цв) + 4H2O(г);
- в) NO2(г) + NO2(г)
N2O4(г);
- г) 3NO2(г) + H2O(в)
2HNO3(в) + NO(г).
4. Адначасовае павышэнне тэмпературы і зніжэннe ціску больш за ўсё зрушвае раўнавагу рэакцыі ўправа:
- a) CO(г) + 2Н2(г)
CН3ОН(г) + Q;
- б) 3O2(г)
2O3(г) – Q;
- в) Н2(г) + СН3–СН=СН2(г)
СН3–СН2–СН3(г) + Q;
- г) С(цв) + Н2О(г)
СO(г) + Н2(г) – Q.
5. У рэакцыі сінтэзу аміяку N2(г) + 3H2(г) 2NH3(г) + Q раўнаважкая колькасць (моль) NH3 павялічыцца пры:
- а) павелічэнні тэмпературы;
- б) памяншэнні ціску;
- в) дадаванні ў рэакцыйную сумесь вадароду;
- г) дадаванні ў рэакцыйную сумесь аміяку.