§ 32. Насыщенные одноосновные карбоновые кислоты. Номенклатура. Изомерия. Физические свойства
Физические свойства
В таблице 32.1 приведены формулы, названия и температуры кипения некоторых карбоновых кислот.
Таблица 32.1. Формулы, названия и температуры кипения некоторых карбоновых кислот
|
Формула |
Название |
tкип, °С |
|
H—COOH |
метановая кислота |
101 |
|
CH3—COOH |
этановая кислота |
118 |
|
CH3—СН2—COOH |
пропановая кислота |
141 |
|
CH3—СН2—СН2—COOH |
бутановая кислота |
164 |
|
CH3—СН2—СН2—СН2—COOH |
пентановая кислота |
185 |
Как видно из данных таблицы, температуры кипения карбоновых кислот значительно выше, чем у альдегидов с тем же числом атомов углерода в молекуле. В отличие от альдегидов, среди карбоновых кислот нет газообразных при комнатной температуре веществ. Отсутствие газообразных веществ мы уже встречали в гомологическом ряду одноатомных спиртов (§ 23). В параграфе 23 указана причина высоких температур кипения спиртов — образование между их молекулами водородных связей. Образование водородных связей между молекулами спиртов возможно благодаря наличию полярных групп —OH.
В молекулах карбоновых кислот, как и в спиртах, имеется группа —OH:
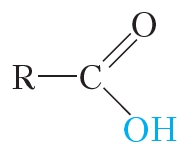 Поэтому между молекулами карбоновых кислот также образуются водородные связи:
Поэтому между молекулами карбоновых кислот также образуются водородные связи:
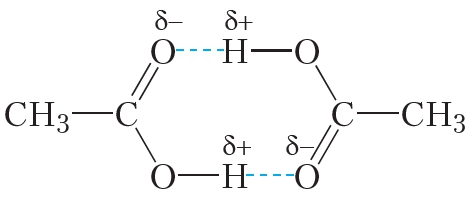
Водородные связи достаточно сильно удерживают молекулы карбоновых кислот друг возле друга, затрудняя переход в газообразное состояние, поэтому карбоновые кислоты имеют высокие температуры кипения.
Простейшие представители карбоновых кислот при обычных условиях представляют собой жидкости с резким запахом. С увеличением размера углеводородного радикала температуры кипения карбоновых кислот увеличиваются. Высшие карбоновые кислоты — пальмитиновая и стеариновая — твёрдые вещества.
Муравьиная, уксусная и пропановая кислоты смешиваются с водой в любых соотношениях, то есть можно приготовить водные растворы этих кислот любого состава. По мере увеличения числа атомов углерода в углеводородном радикале растворимость карбоновых кислот в воде уменьшается. Высшие карбоновые кислоты — пальмитиновая и стеариновая — в воде нерастворимы.
|
По систематической номенклатуре карбоксильная группа обозначается сочетанием «-овая кислота». В соответствии с систематической номенклатурой название карбоновой кислоты состоит из названия углеводорода с тем же, что и у кислоты, числом атомов углерода в молекуле и окончания «-овая кислота». Нумерацию атомов углерода главной цепи начинают с атома углерода карбоксильной группы. Между молекулами карбоновых кислот образуются водородные связи, что обусловливает их высокие температуры кипения. |