§ 32. Насыщенные одноосновные карбоновые кислоты. Номенклатура. Изомерия. Физические свойства
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 32. Насыщенные одноосновные карбоновые кислоты. Номенклатура. Изомерия. Физические свойства |
| Напечатано:: | Гость |
| Дата: | Saturday, 1 November 2025, 08:50 |
Насыщенные одноосновные карбоновые кислоты. Номенклатура. Изомерия. Физические свойства
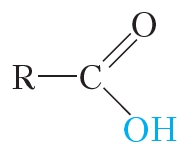
В молекуле первого представителя гомологического ряда насыщенных одноосновных карбоновых кислот карбоксильная группа связана с атомом водорода:

Как вы уже знаете, это соединение называется муравьиная кислота. Муравьиная кислота впервые была выделена из лесных муравьёв, чем и обусловлено её название. В природе муравьиная кислота встречается также в крапиве, некоторых фруктах, едких выделениях медуз и т. д. Муравьиная кислота при комнатной температуре представляет собой бесцветную жидкость с резким запахом, температура кипения 101 °С.
Формула следующего представителя гомологического ряда насыщенных одноосновных карбоновых кислот:
 Это соединение называется уксусная кислота. Уксусная кислота так же, как и муравьиная, при комнатной температуре — бесцветная жидкость с резким запахом. Температура кипения уксусной кислоты составляет 118 °С.
Это соединение называется уксусная кислота. Уксусная кислота так же, как и муравьиная, при комнатной температуре — бесцветная жидкость с резким запахом. Температура кипения уксусной кислоты составляет 118 °С.Молекулы гомологов уксусной кислоты отличаются от неё на одну или несколько групп CH2 и имеют общую формулу CnH2n+1 —COOH.
Известны гомологи уксусной кислоты, углеводородный радикал которых включает достаточно длинную цепь из атомов углерода. Важнейшими представителями таких кислот являются пальмитиновая С15Н31 —СООН и стеариновая С17Н35 —СООН.
В молекулах пальмитиновой и стеариновой кислот углеводородные радикалы имеют неразветвлённое строение. Шаростержневая модель молекулы пальмитиновой кислоты:
 Пальмитиновая и стеариновая кислоты выделены из продуктов переработки жиров и имеют название высшие жирные кислоты.
Пальмитиновая и стеариновая кислоты выделены из продуктов переработки жиров и имеют название высшие жирные кислоты.Эти кислоты представляют собой твёрдые бесцветные вещества, нерастворимые в воде. Температуры плавления пальмитиновой и стеариновой кислот составляют 63 и 70 °С соответственно.
Изомерия
Для карбоновых кислот возможна изомерия углеродного скелета. Этот вид изомерии так же, как и в случае альдегидов, появляется, начиная с вещества, содержащего четыре атома углерода в молекуле:
 Так как карбоксильная группа всегда располагается в начале молекулы, то изомерия, связанная с положением карбоксильной группы, невозможна.
Так как карбоксильная группа всегда располагается в начале молекулы, то изомерия, связанная с положением карбоксильной группы, невозможна.Номенклатура
Названия муравьиная и уксусная кислоты являются исторически сложившимися, или тривиальными, названиями. По систематической номенклатуре карбоксильная группа обозначается сочетанием «-овая кислота». Название кислоты состоит из названия алкана с тем же, что и у кислоты, числом атомов углерода в молекуле и окончания «-овая кислота». Нумерацию атомов углерода главной цепи всегда начинают с атома углерода карбоксильной группы.
Назовём все упомянутые выше карбоновые кислоты: Используя правила систематической номенклатуры, можно назвать карбоновые кислоты, молекулы которых имеют более сложное строение, например:
Используя правила систематической номенклатуры, можно назвать карбоновые кислоты, молекулы которых имеют более сложное строение, например:

Главная цепь состоит из семи атомов углерода. Соответствующий алкан называется гептан. Третий и пятый атомы углерода главной цепи связаны с алкильными радикалами, названия которых перечисляются в алфавитном порядке. Принадлежность соединения к классу карбоновых кислот указываем при помощи сочетания «-овая кислота». Тогда название карбоновой кислоты — 5-метил-3-этилгептановая кислота.
 С межклассовой изомерией карбоновых кислот и сложных эфиров вы можете познакомиться, перейдя по ссылке в QR-коде.
С межклассовой изомерией карбоновых кислот и сложных эфиров вы можете познакомиться, перейдя по ссылке в QR-коде.
Физические свойства
В таблице 32.1 приведены формулы, названия и температуры кипения некоторых карбоновых кислот.
Таблица 32.1. Формулы, названия и температуры кипения некоторых карбоновых кислот
|
Формула |
Название |
tкип, °С |
|
H—COOH |
метановая кислота |
101 |
|
CH3—COOH |
этановая кислота |
118 |
|
CH3—СН2—COOH |
пропановая кислота |
141 |
|
CH3—СН2—СН2—COOH |
бутановая кислота |
164 |
|
CH3—СН2—СН2—СН2—COOH |
пентановая кислота |
185 |
Как видно из данных таблицы, температуры кипения карбоновых кислот значительно выше, чем у альдегидов с тем же числом атомов углерода в молекуле. В отличие от альдегидов, среди карбоновых кислот нет газообразных при комнатной температуре веществ. Отсутствие газообразных веществ мы уже встречали в гомологическом ряду одноатомных спиртов (§ 23). В параграфе 23 указана причина высоких температур кипения спиртов — образование между их молекулами водородных связей. Образование водородных связей между молекулами спиртов возможно благодаря наличию полярных групп —OH.
В молекулах карбоновых кислот, как и в спиртах, имеется группа —OH:
 Поэтому между молекулами карбоновых кислот также образуются водородные связи:
Поэтому между молекулами карбоновых кислот также образуются водородные связи:
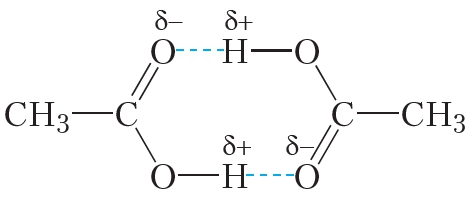
Водородные связи достаточно сильно удерживают молекулы карбоновых кислот друг возле друга, затрудняя переход в газообразное состояние, поэтому карбоновые кислоты имеют высокие температуры кипения.
Простейшие представители карбоновых кислот при обычных условиях представляют собой жидкости с резким запахом. С увеличением размера углеводородного радикала температуры кипения карбоновых кислот увеличиваются. Высшие карбоновые кислоты — пальмитиновая и стеариновая — твёрдые вещества.
Муравьиная, уксусная и пропановая кислоты смешиваются с водой в любых соотношениях, то есть можно приготовить водные растворы этих кислот любого состава. По мере увеличения числа атомов углерода в углеводородном радикале растворимость карбоновых кислот в воде уменьшается. Высшие карбоновые кислоты — пальмитиновая и стеариновая — в воде нерастворимы.
|
По систематической номенклатуре карбоксильная группа обозначается сочетанием «-овая кислота». В соответствии с систематической номенклатурой название карбоновой кислоты состоит из названия углеводорода с тем же, что и у кислоты, числом атомов углерода в молекуле и окончания «-овая кислота». Нумерацию атомов углерода главной цепи начинают с атома углерода карбоксильной группы. Между молекулами карбоновых кислот образуются водородные связи, что обусловливает их высокие температуры кипения. |
*Межклассовая изомерия карбоновых кислот и сложных эфиров
Для карбоновых кислот возможна межклассовая изомерия со сложными эфирами. Например, уксусная кислота изомерна метиловому эфиру муравьиной кислоты (метилформиату):
![]()
Как видно, состав обоих веществ может быть выражен одинаковой молекулярной формулой C2H4O2.
Существует два сложных эфира, изомерных пропановой кислоте:
![]()
Всем трём веществам соответствует молекулярная формула С3Н6О2.
Подробнее о построении названий сложных эфиров вы можете прочитать в § 38.
Вопросы и задания
1. Укажите шаростержневую модель пропановой кислоты:

Напишите структурные формулы одноосновных карбоновых кислот состава C5H10O2 и назовите их по систематической номенклатуре.
2. На рисунке приведены модели молекул муравьиной и уксусной кислот:

Укажите типы гибридизации атомов углерода в молекулах этих соединений и приблизительные значения валентных углов.
3. Расположите в порядке увеличения температуры кипения следующие вещества: этанол, уксусный альдегид, уксусная кислота. Ответ поясните.
4. Изобразите образование водородных связей между молекулами уксусной кислоты и воды.
5. За счёт образования водородных связей в пара́х муравьиная кислота существует как в виде отдельных молекул, так и в виде циклических димеров:

Определите среднюю молярную массу паров, состоящих из муравьиной кислоты и её димера, если известно, что в пара́х на 100 отдельных молекул муравьиной кислоты приходится 30 молекул димера.