§ 23. Физические свойства спиртов. Водородная связь и её влияние на свойства спиртов
Растворимость спиртов в воде
Рассматривая растворимость спиртов, снова вспомним принцип «подобное растворяется в подобном». В отличие от углеводородов, в молекулах спиртов имеется полярная группа —OH. Полярная группа —OH придаёт спиртам растворимость в воде, молекулы которой являются полярными. Углеводородный радикал, напротив, «мешает» спиртам растворяться в воде: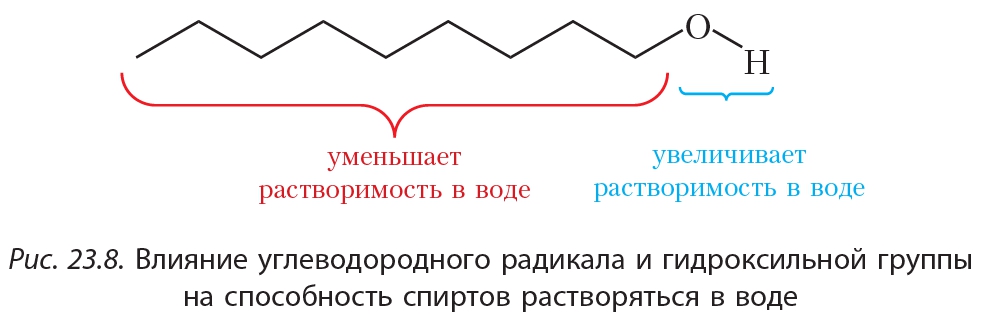
Действительно, метанол, этанол и изомерные пропанолы смешиваются с водой в любых соотношениях, с увеличением числа атомов углерода в молекуле спирта растворимость в воде уменьшается.
Как видно, наличие гидроксильных групп в молекулах спиртов придаёт этим веществам свойства, отличные от свойств углеводородов. Спирты имеют высокие температуры кипения, низшие спирты хорошо растворяются в воде. Химические свойства спиртов также имеют ряд особенностей, об этом пойдёт речь в следующем параграфе.|
При переходе вещества из жидкого состояния в газообразное преодолеваются силы межмолекулярного взаимодействия. Поэтому, чем сильнее взаимодействие между молекулами вещества, тем выше его температура кипения. Особым видом межмолекулярного взаимодействия является водородная связь. Благодаря наличию полярных групп —OH между молекулами спиртов образуются водородные связи, поэтому температуры кипения спиртов намного выше температур кипения алканов с таким же числом атомов углерода в молекулах. Полярная группа —OH придаёт спиртам растворимость в воде. Метанол, этанол и изомерные пропанолы неограниченно растворимы в воде, с увеличением числа атомов углерода в молекуле спирта растворимость в воде уменьшается. |