§ 23. Физические свойства спиртов. Водородная связь и её влияние на свойства спиртов
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 23. Физические свойства спиртов. Водородная связь и её влияние на свойства спиртов |
| Напечатано:: | Гость |
| Дата: | Пятница, 15 Август 2025, 19:08 |
Физические свойства спиртов. Водородная связь и её влияние на свойства спиртов
При обычных условиях спирты представляют собой бесцветные жидкости с характерным запахом. Высшие спирты, молекулы которых содержат большое число атомов углерода, — твёрдые вещества, похожие на парафин.
Интересно знать
Многие спирты обнаружены в природных объектах. Так, известный сорняк борщевик содержит метанол; к классу спиртов относится холестерин, который при неправильном питании откладывается на стенках сосудов и препятствует кровотоку. Вместе с тем, многие спирты имеют приятный запах, например ментол, содержащийся в листьях, стеблях и корнях мяты:  В таблице 23.1 приведены структурные формулы, названия и температуры кипения насыщенных одноатомных спиртов.
В таблице 23.1 приведены структурные формулы, названия и температуры кипения насыщенных одноатомных спиртов.
Таблица 23.1. Структурные формулы, названия и температуры кипения насыщенных одноатомных спиртов СnH2n+1—OH
|
Формула |
Название |
tкип, °C |
|
СН3—OH |
метанол |
65 |
|
СН3—CH2—OH |
этанол |
78 |
|
CH3—CH2—CH2—OH |
пропанол-1 |
97 |
|
CH3—CH2—CH2—CH2—OH |
бутанол-1 |
118 |
|
CH3—CH2—CH2—CH2—CH2—OH |
пентанол-1 |
138 |
Межмолекулярное взаимодействие и водородная связь
Из таблицы 23.1 видно, что в отличие от углеводородов, в гомологическом ряду насыщенных одноатомных спиртов отсутствуют газообразные вещества. Даже простейший спирт — метанол — при обычных условиях жидкость с температурой кипения 65 °С.
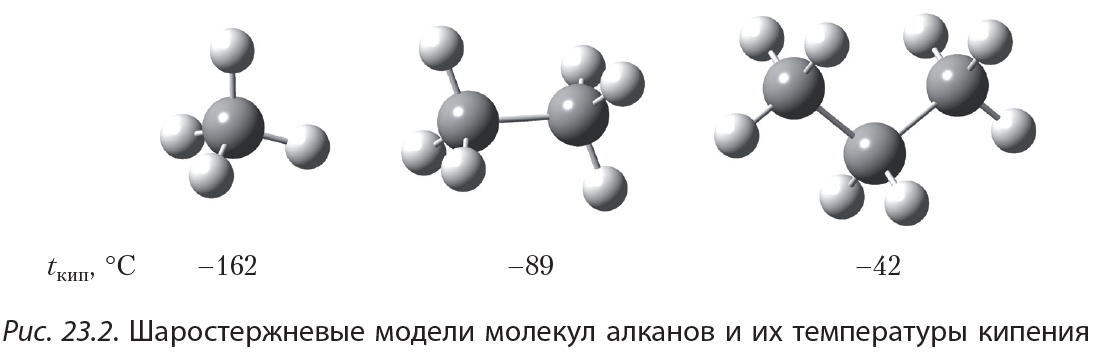
Изучая физические свойства алканов (§ 8), мы видели, что их температуры кипения растут с увеличением размеров молекул. На рисунке 23.2 изображены шаростержневые модели молекул метана, этана, пропана и указаны их температуры кипения:
 Размеры молекул этана и метанола близки, поэтому можно было бы ожидать, что эти вещества будут иметь близкие температуры кипения. Тем не менее, температуры кипения этана и метанола различаются более чем на 150 °С и составляют –89 и +65 °С соответственно:
Размеры молекул этана и метанола близки, поэтому можно было бы ожидать, что эти вещества будут иметь близкие температуры кипения. Тем не менее, температуры кипения этана и метанола различаются более чем на 150 °С и составляют –89 и +65 °С соответственно: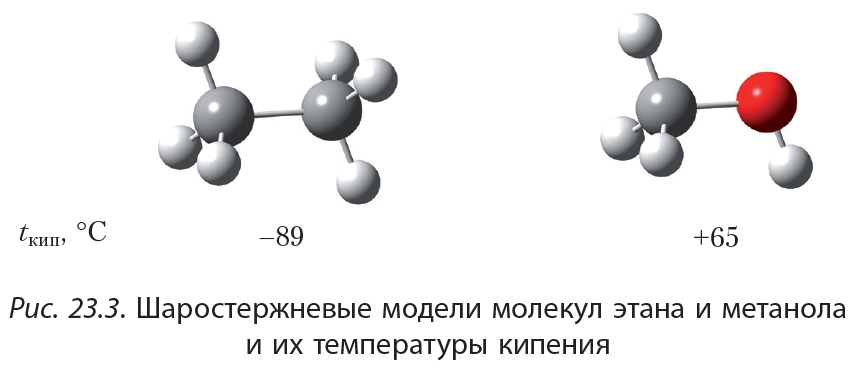 В чём же причина аномально высоких температур кипения спиртов? Объяснение этого явления заключается в следующем. Молекулы жидкости находятся близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются, то есть существуют силы, которые удерживают молекулы жидкости вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Чтобы превратить жидкость в газ необходимо преодолеть силы межмолекулярного взаимодействия:
В чём же причина аномально высоких температур кипения спиртов? Объяснение этого явления заключается в следующем. Молекулы жидкости находятся близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются, то есть существуют силы, которые удерживают молекулы жидкости вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Чтобы превратить жидкость в газ необходимо преодолеть силы межмолекулярного взаимодействия:
 Очевидно, что чем сильнее взаимодействие между молекулами вещества, тем выше его температура кипения.
Очевидно, что чем сильнее взаимодействие между молекулами вещества, тем выше его температура кипения.
Силы межмолекулярного взаимодействия имеют электростатическую природу. Очень слабым будет взаимодействие между молекулами, имеющими малые размеры и на атомах которых отсутствуют частичные электрические заряды, то есть между маленькими неполярными молекулами.
Пример. Температуры кипения азота N2 и кислорода O2 очень низкие и равны –196 и –183 °С соответственно. Это объясняется тем, что молекулы этих веществ имеют малые размеры, связи в молекулах неполярные, частичные заряды на атомах отсутствуют, поэтому молекулы очень слабо притягиваются друг к другу.
В ряду «метан — этан — пропан» с ростом размеров молекул увеличивается площадь их соприкосновения и, следовательно, увеличивается межмолекулярное взаимодействие (рис. 23.2). Поэтому в гомологическом ряду алканов по мере увеличения числа атомов углерода в молекуле растут температуры кипения.
Межмолекулярное взаимодействие усиливается при появлении в молекуле полярных связей. В молекулах с ковалентными полярными связями электронная плотность распределена неравномерно. Например, в молекуле хлороводорода HCl общая электронная пара смещена к более электроотрицательному атому хлора. В результате на атоме хлора возникает частичный отрицательный заряд, на атоме водорода — частичный положительный (§ 4).
Благодаря наличию частичных зарядов атом водорода одной молекулы HCl будет притягиваться к атому хлора другой молекулы: 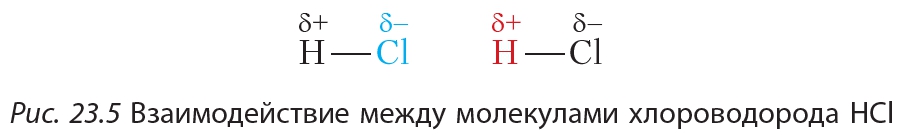 Температура кипения хлороводорода равна –61 °С.
Температура кипения хлороводорода равна –61 °С.
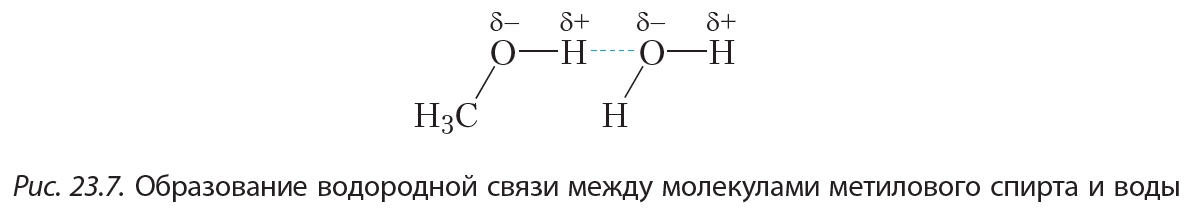
Ещё более сильное взаимодействие имеется между молекулами спиртов. Рассмотрим это на примере метилового спирта. Атом водорода гидроксильной группы —О—Н молекулы метанола образует с атомом кислорода сильнополярную связь. Это объясняется тем, что кислород — один из самых электроотрицательных элементов — уступает по электроотрицательности только фтору. Таким образом, атом водорода, соединяясь с кислородом, практически лишается своего электронного облака. Обладая малыми размерами и, в отличие от других атомов, не имея внутренних электронных слоёв, такой атом водорода способен проникать в электронные оболочки атомов других молекул. В результате между молекулами метанола возникает особый тип межмолекулярного взаимодействия — водородная связь: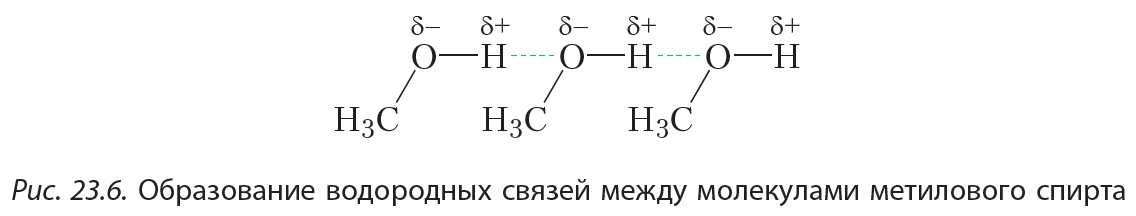 Водородную связь принято обозначать пунктирной линией. Водородные связи достаточно сильно удерживают молекулы метанола друг возле друга, поэтому температура кипения метанола (+65 °С) значительно выше температуры кипения этана (–89 °С), между молекулами которого водородные связи отсутствуют, несмотря на то, что размеры молекул этих веществ близки.
Водородную связь принято обозначать пунктирной линией. Водородные связи достаточно сильно удерживают молекулы метанола друг возле друга, поэтому температура кипения метанола (+65 °С) значительно выше температуры кипения этана (–89 °С), между молекулами которого водородные связи отсутствуют, несмотря на то, что размеры молекул этих веществ близки.
Энергия водородной связи примерно в 10 раз меньше энергии ковалентной связи, поэтому водородную связь не принято считать отдельным типом химической связи. Это особый вид сильного межмолекулярного взаимодействия.
Молекулы спиртов образуют водородные связи не только между собой, но и с молекулами воды (рис. 23.7).
Растворимость спиртов в воде
Рассматривая растворимость спиртов, снова вспомним принцип «подобное растворяется в подобном». В отличие от углеводородов, в молекулах спиртов имеется полярная группа —OH. Полярная группа —OH придаёт спиртам растворимость в воде, молекулы которой являются полярными. Углеводородный радикал, напротив, «мешает» спиртам растворяться в воде: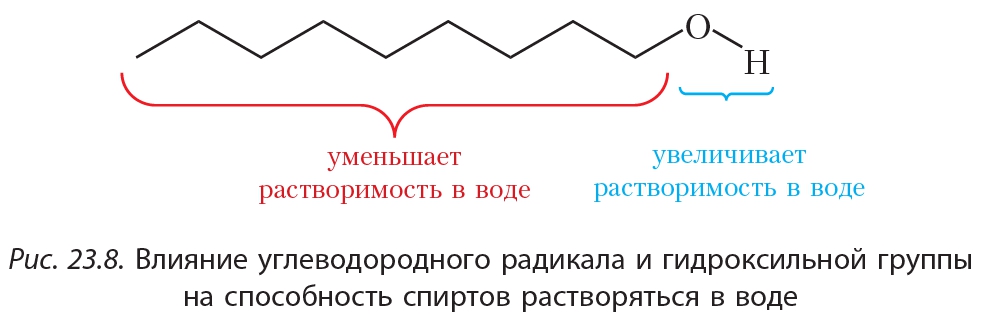
Действительно, метанол, этанол и изомерные пропанолы смешиваются с водой в любых соотношениях, с увеличением числа атомов углерода в молекуле спирта растворимость в воде уменьшается.
Как видно, наличие гидроксильных групп в молекулах спиртов придаёт этим веществам свойства, отличные от свойств углеводородов. Спирты имеют высокие температуры кипения, низшие спирты хорошо растворяются в воде. Химические свойства спиртов также имеют ряд особенностей, об этом пойдёт речь в следующем параграфе.|
При переходе вещества из жидкого состояния в газообразное преодолеваются силы межмолекулярного взаимодействия. Поэтому, чем сильнее взаимодействие между молекулами вещества, тем выше его температура кипения. Особым видом межмолекулярного взаимодействия является водородная связь. Благодаря наличию полярных групп —OH между молекулами спиртов образуются водородные связи, поэтому температуры кипения спиртов намного выше температур кипения алканов с таким же числом атомов углерода в молекулах. Полярная группа —OH придаёт спиртам растворимость в воде. Метанол, этанол и изомерные пропанолы неограниченно растворимы в воде, с увеличением числа атомов углерода в молекуле спирта растворимость в воде уменьшается. |
Вопросы и задания
1. Как наличие гидроксильных групп в молекулах спиртов отражается на их физических свойствах?
2. Почему температуры кипения спиртов гораздо выше, чем углеводородов с таким же числом атомов углерода в молекуле?
3. Почему температура кипения диметилового эфира (–25 оС) намного ниже, чем температура кипения этилового спирта (78 оС)?
4. Почему температура кипения растёт в ряду веществ: метанол, этанол, пропанол-1?
5. Объясните, почему с ростом числа атомов углерода в молекулах спиртов их растворимость в воде уменьшается.
6*. Одна молекула воды может образовать четыре водородные связи. Сколько водородных связей может образовать одна молекула метанола?
7*. Молярную массу веществ, представляющих собой легкокипящие жидкости, можно измерить с помощью прибора, изображённого на рисунке:
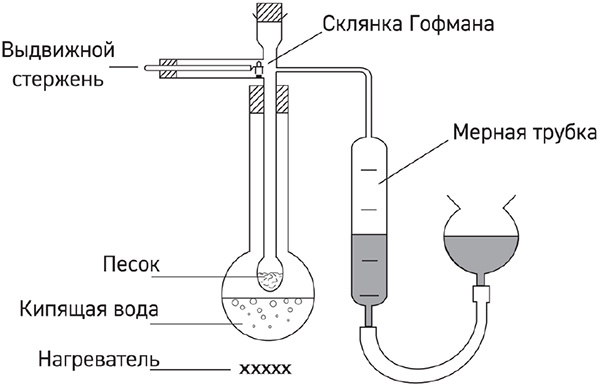
Для определения молярной массы неизвестной жидкости X 1,000 г её поместили в склянку Гофмана (небольшой стеклянный стаканчик). После того как при помощи выдвижного стержня склянка была сброшена на нагретый песок и вещество X полностью испарилось, из мерной трубки было вытеснено 760 мл жидкости.
а) По результатам описанного эксперимента рассчитайте молярную массу вещества X, если известно, что плотность пентана, измеренная в условиях опыта, равна 2,554 г/дм3.
б) Значение молярной массы вещества X, определённое другими методами, равно 32 г/моль. Установлено, что ошибка при определении молярной массы в описанном эксперименте обусловлена тем, что в парах вещество X частично димеризовано. Используя правильное значение молярной массы и результаты, полученные в п. а), рассчитайте, сколько молекул X2 приходится на каждые 100 молекул Х в парах.
в) Предложите возможную структуру вещества Х и объясните причину его димеризации.
(Ответ:
а) M = m/n = 1,47/0,0396 = 37,1 г/моль.
б) На 100 молекул мономера приходится 18,6 или 19 молекул димера.
в) Веществом Х является метанол, который частично димеризован в парах за счёт образования водородных связей между молекулами.)