§ 23. Физические свойства спиртов. Водородная связь и её влияние на свойства спиртов
Межмолекулярное взаимодействие и водородная связь
Из таблицы 23.1 видно, что в отличие от углеводородов, в гомологическом ряду насыщенных одноатомных спиртов отсутствуют газообразные вещества. Даже простейший спирт — метанол — при обычных условиях жидкость с температурой кипения 65 °С.
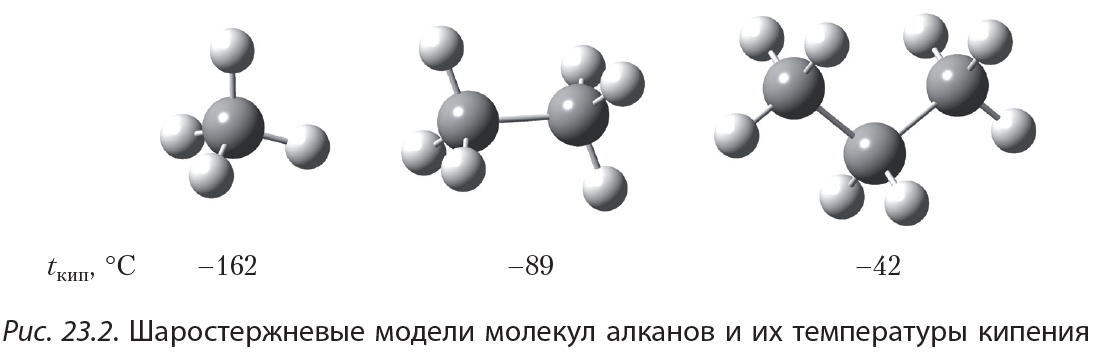
Изучая физические свойства алканов (§ 8), мы видели, что их температуры кипения растут с увеличением размеров молекул. На рисунке 23.2 изображены шаростержневые модели молекул метана, этана, пропана и указаны их температуры кипения:
 Размеры молекул этана и метанола близки, поэтому можно было бы ожидать, что эти вещества будут иметь близкие температуры кипения. Тем не менее, температуры кипения этана и метанола различаются более чем на 150 °С и составляют –89 и +65 °С соответственно:
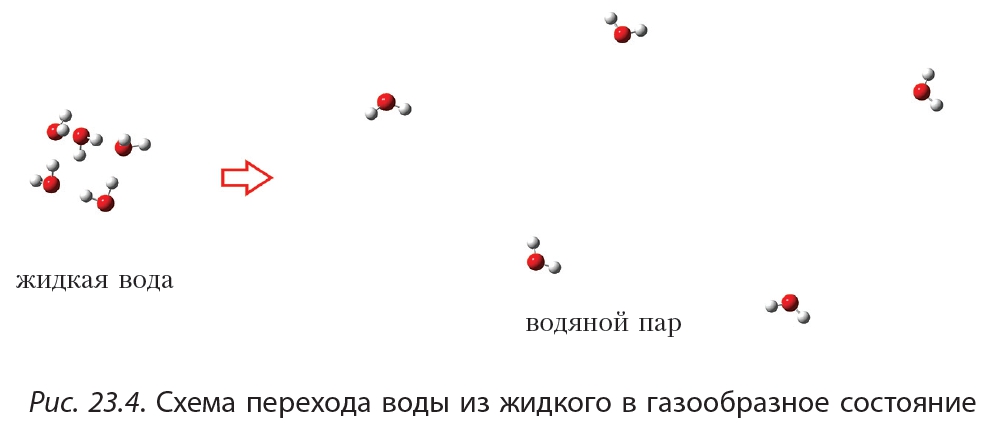
Размеры молекул этана и метанола близки, поэтому можно было бы ожидать, что эти вещества будут иметь близкие температуры кипения. Тем не менее, температуры кипения этана и метанола различаются более чем на 150 °С и составляют –89 и +65 °С соответственно: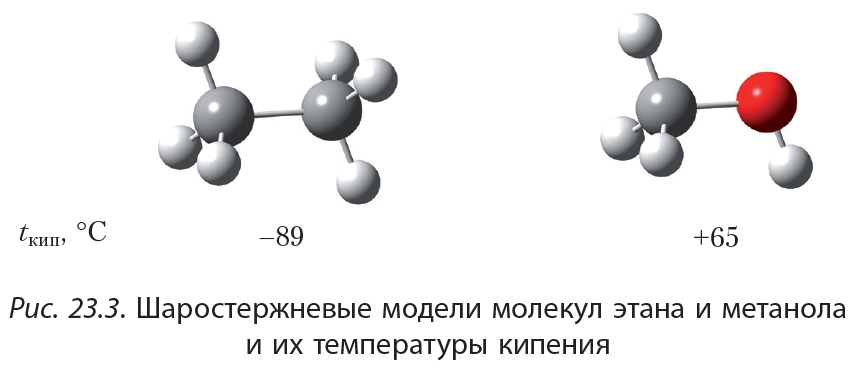 В чём же причина аномально высоких температур кипения спиртов? Объяснение этого явления заключается в следующем. Молекулы жидкости находятся близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются, то есть существуют силы, которые удерживают молекулы жидкости вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Чтобы превратить жидкость в газ необходимо преодолеть силы межмолекулярного взаимодействия:
В чём же причина аномально высоких температур кипения спиртов? Объяснение этого явления заключается в следующем. Молекулы жидкости находятся близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются, то есть существуют силы, которые удерживают молекулы жидкости вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Чтобы превратить жидкость в газ необходимо преодолеть силы межмолекулярного взаимодействия:
 Очевидно, что чем сильнее взаимодействие между молекулами вещества, тем выше его температура кипения.
Очевидно, что чем сильнее взаимодействие между молекулами вещества, тем выше его температура кипения.
Силы межмолекулярного взаимодействия имеют электростатическую природу. Очень слабым будет взаимодействие между молекулами, имеющими малые размеры и на атомах которых отсутствуют частичные электрические заряды, то есть между маленькими неполярными молекулами.
Пример. Температуры кипения азота N2 и кислорода O2 очень низкие и равны –196 и –183 °С соответственно. Это объясняется тем, что молекулы этих веществ имеют малые размеры, связи в молекулах неполярные, частичные заряды на атомах отсутствуют, поэтому молекулы очень слабо притягиваются друг к другу.
В ряду «метан — этан — пропан» с ростом размеров молекул увеличивается площадь их соприкосновения и, следовательно, увеличивается межмолекулярное взаимодействие (рис. 23.2). Поэтому в гомологическом ряду алканов по мере увеличения числа атомов углерода в молекуле растут температуры кипения.
Межмолекулярное взаимодействие усиливается при появлении в молекуле полярных связей. В молекулах с ковалентными полярными связями электронная плотность распределена неравномерно. Например, в молекуле хлороводорода HCl общая электронная пара смещена к более электроотрицательному атому хлора. В результате на атоме хлора возникает частичный отрицательный заряд, на атоме водорода — частичный положительный (§ 4).
Благодаря наличию частичных зарядов атом водорода одной молекулы HCl будет притягиваться к атому хлора другой молекулы: 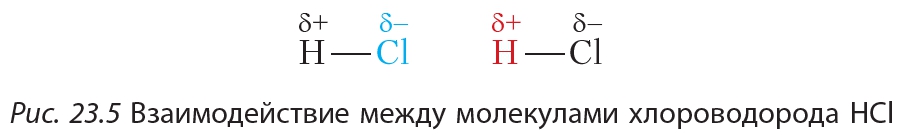 Температура кипения хлороводорода равна –61 °С.
Температура кипения хлороводорода равна –61 °С.
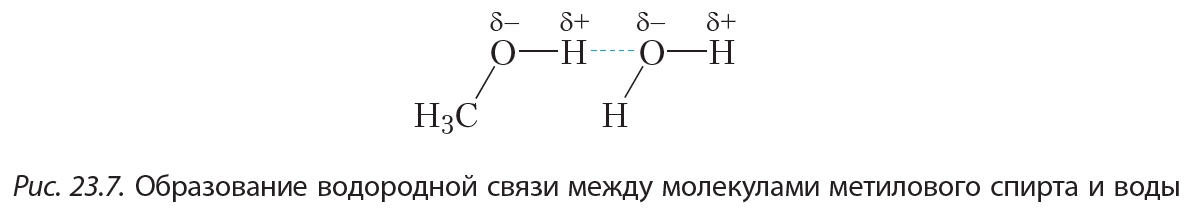
Ещё более сильное взаимодействие имеется между молекулами спиртов. Рассмотрим это на примере метилового спирта. Атом водорода гидроксильной группы —О—Н молекулы метанола образует с атомом кислорода сильнополярную связь. Это объясняется тем, что кислород — один из самых электроотрицательных элементов — уступает по электроотрицательности только фтору. Таким образом, атом водорода, соединяясь с кислородом, практически лишается своего электронного облака. Обладая малыми размерами и, в отличие от других атомов, не имея внутренних электронных слоёв, такой атом водорода способен проникать в электронные оболочки атомов других молекул. В результате между молекулами метанола возникает особый тип межмолекулярного взаимодействия — водородная связь: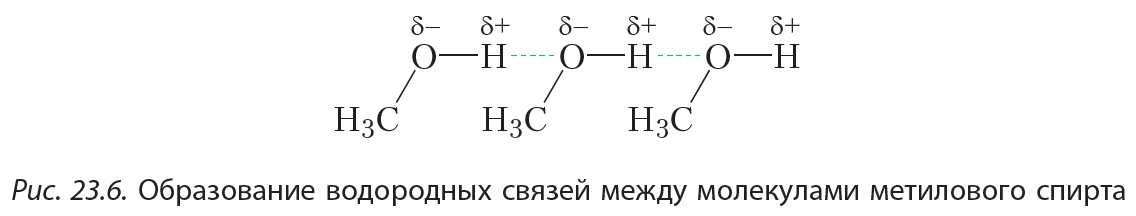 Водородную связь принято обозначать пунктирной линией. Водородные связи достаточно сильно удерживают молекулы метанола друг возле друга, поэтому температура кипения метанола (+65 °С) значительно выше температуры кипения этана (–89 °С), между молекулами которого водородные связи отсутствуют, несмотря на то, что размеры молекул этих веществ близки.
Водородную связь принято обозначать пунктирной линией. Водородные связи достаточно сильно удерживают молекулы метанола друг возле друга, поэтому температура кипения метанола (+65 °С) значительно выше температуры кипения этана (–89 °С), между молекулами которого водородные связи отсутствуют, несмотря на то, что размеры молекул этих веществ близки.
Энергия водородной связи примерно в 10 раз меньше энергии ковалентной связи, поэтому водородную связь не принято считать отдельным типом химической связи. Это особый вид сильного межмолекулярного взаимодействия.
Молекулы спиртов образуют водородные связи не только между собой, но и с молекулами воды (рис. 23.7).