§ 19. Ароматические углеводороды. Бензол, строение молекулы
Ароматические углеводороды. Бензол, строение молекулы
Название «ароматические соединения» возникло потому, что первые известные представители этого класса, полученные ещё в начале XIX века, обладали приятным запахом. Позднее оказалось, что большинство веществ, которые по строению и химическим свойствам принадлежат к этой же группе, не имеют приятного запаха. Однако исторически сложившееся общее название этих соединений сохранилось.
Простейшим представителем ароматических углеводородов является бензол. Его молекулярная формула C6H6.
Бензол — легкокипящая (tкип = 80 °С), бесцветная, нерастворимая в воде
жидкость с характерным запахом. При охлаждении бензол легко застывает в белую кристаллическую массу с температурой плавления 5,5 °С.
Открыл бензол великий английский физик Майкл Фарадей. В 1825 году ему удалось выделить бензол из каменноугольной смолы. Позже были установлены простейшая CH и молекулярная C6H6 формулы бензола. Однако долгое время не удавалось установить строение молекулы данного вещества. Через сорок лет после открытия бензола немецкий химик Август Кекуле сделал правильное предположение о циклическом строении молекулы бензола и предложил следующую структурную формулу:
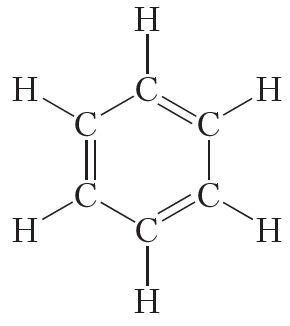
Представленная формула бензола называется формулой Кекуле. Формула Кекуле показывает, что молекула бензола имеет плоское строение, валентные углы равны 120°. Из формулы Кекуле также следует, что для гидрирования молекулы бензола до циклогексана требуются три молекулы водорода:
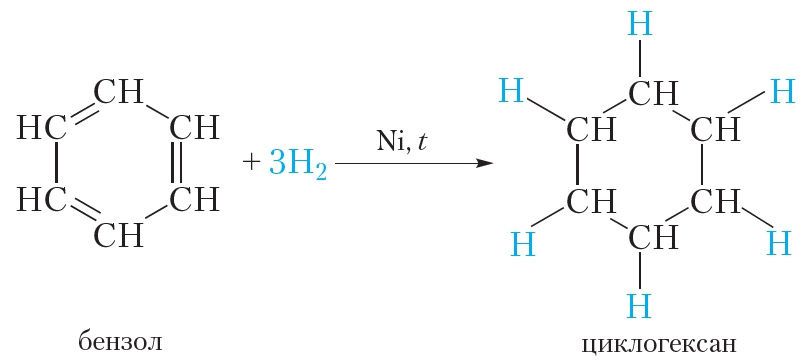
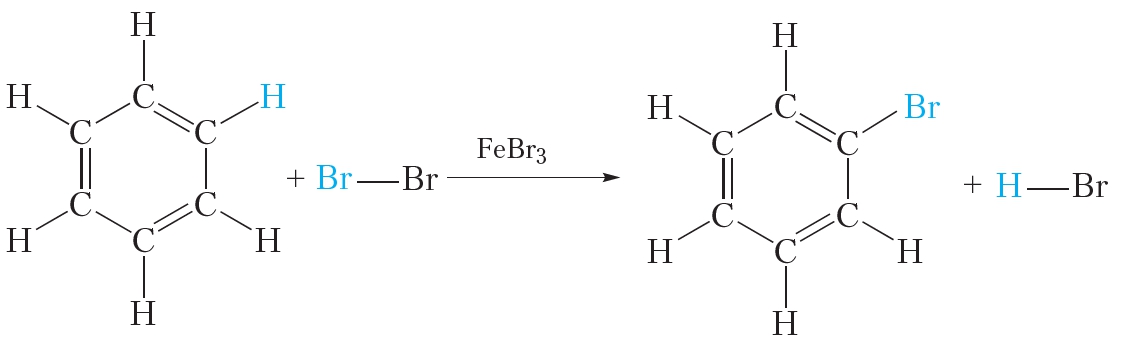
Все эти выводы подтверждаются экспериментальными данными. Однако формула Кекуле не объясняет ряд особых свойств бензола. Так, бензол не вступает в качественные реакции на двойную ![]() связь. Он, в отличие от алкенов, не обесцвечивает бромную воду и раствор перманганата калия. В присутствии катализатора бензол реагирует с галогенами, однако при этом происходит не присоединение галогена, а замещение атома водорода в молекуле бензола на галоген:
связь. Он, в отличие от алкенов, не обесцвечивает бромную воду и раствор перманганата калия. В присутствии катализатора бензол реагирует с галогенами, однако при этом происходит не присоединение галогена, а замещение атома водорода в молекуле бензола на галоген:
Кроме того, экспериментально установлено, что все связи углерод-углерод в молекуле бензола имеют одинаковую длину. Столь необычные свойства бензола удалось объяснить только в ХХ веке, используя современную теорию строения вещества.
Из формулы Кекуле следует, что двойные связи в молекуле бензола являются сопряжёнными. На примере бутадиена-1,3 мы видели, что сопряжение ведёт к некоторому выравниванию длин двойных и одинарных связей. В молекуле бензола сопряжение настолько сильное, что длины всех связей углерод-углерод становятся одинаковыми:
 Таким образом, в молекуле бензола нет двойных и одинарных связей. Каждый атом углерода в молекуле бензола, как и в бутадиене-1,3, находится в состоянии sp2-гибридизации. π-Электроны делокализованы и образуют не три отдельные π-связи, а единую π-систему (сопряжённую систему π-связей):
Таким образом, в молекуле бензола нет двойных и одинарных связей. Каждый атом углерода в молекуле бензола, как и в бутадиене-1,3, находится в состоянии sp2-гибридизации. π-Электроны делокализованы и образуют не три отдельные π-связи, а единую π-систему (сопряжённую систему π-связей): 
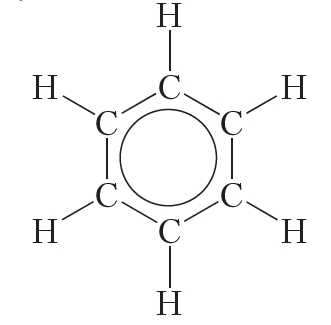
Наряду с формулой бензола, в которой показана делокализация π-электронов, нередко пользуются формулой Кекуле, учитывая при этом, что она не совсем точно передаёт строение бензола:
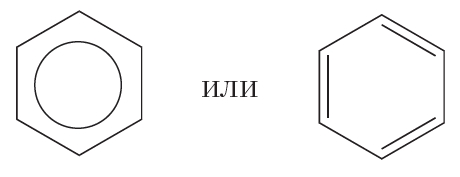
Делокализация π-электронов придаёт молекуле бензола дополнительную устойчивость. Поэтому для бензола характерны реакции, в которых сопряжённая система π-связей в молекуле сохраняется. Такими реакциями являются реакции замещения (см. уравнение реакции с бромом).
Как уже отмечалось, бензол является простейшим представителем ароматических углеводородов. Его гомологи могут рассматриваться как продукты замещения одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы. Формулы и названия некоторых гомологов бензола приведены на рисунке 19.3.
Как видно, для построения названий веществ, в молекулах которых с бензольным кольцом соединено несколько углеводородных радикалов, атомы углерода бензольного кольца нумеруют таким образом, чтобы заместители получили наименьшие номера, и при помощи цифр в названии указывают положение заместителей. 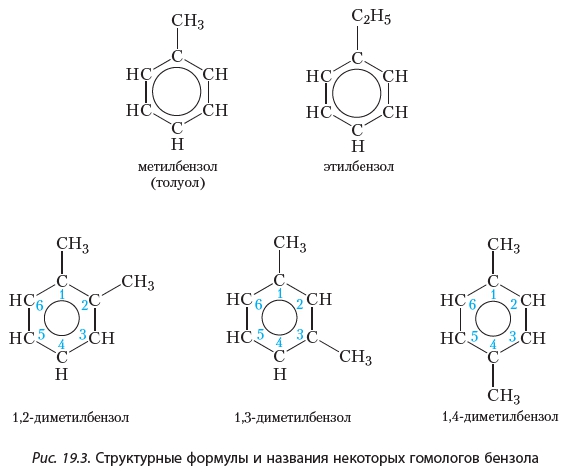
|
Бензол С6Н6 — простейший представитель класса ароматических углеводородов. Молекула бензола имеет плоское строение, валентные углы равны 120°, длины всех связей углерод-углерод одинаковы. π-Электроны в молекуле бензола делокализованы и образуют единую сопряжённую систему π-связей. Сопряжённая система π-связей придаёт молекуле бензола повышенную устойчивость, поэтому для бензола характерны реакции, в которых сопряжённая система сохраняется. |