§ 17. Алкадиены
Строение бутадиена-1,3
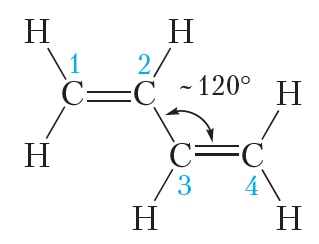
Все четыре атома углерода в молекуле бутадиена-1,3 находятся в состоянии sp2-гибридизации. Три гибридные орбитали каждого атома углерода располагаются в одной плоскости под углами 120°. Соответственно, атомы в молекуле бутадиена-1,3 также располагаются в одной плоскости, валентные углы примерно равны 120°:
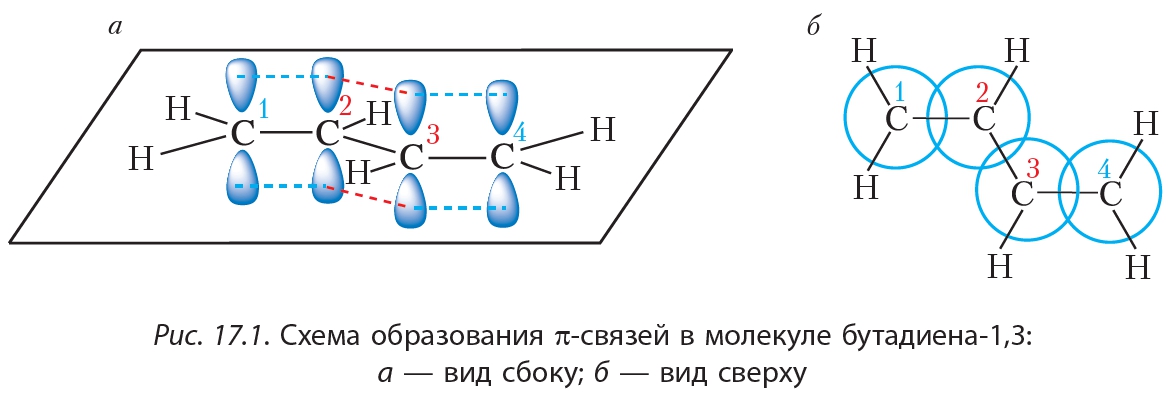
Негибридные p-орбитали каждого атома углерода располагаются перпендикулярно плоскости молекулы. При перекрывании негибридных p-орбиталей образуются π-связи:
Из рисунка 17.1, б видно, что перекрывание негибридных p-орбиталей происходит между связанными двойными связями атомами углерода ![]() и
и ![]() . Но, кроме того, в данной молекуле имеется перекрывание p-орбиталей между вторым и третьим атомами углерода. Таким образом, π-связи в молекуле бутадиена-1,3 не являются изолированными, они образуют единую сопряжённую систему, охватывающую все четыре атома углерода. Другими словами, π-электроны в молекуле бутадиена не принадлежат отдельным связям. В этом случае говорят, что π-электроны делокализованы.
. Но, кроме того, в данной молекуле имеется перекрывание p-орбиталей между вторым и третьим атомами углерода. Таким образом, π-связи в молекуле бутадиена-1,3 не являются изолированными, они образуют единую сопряжённую систему, охватывающую все четыре атома углерода. Другими словами, π-электроны в молекуле бутадиена не принадлежат отдельным связям. В этом случае говорят, что π-электроны делокализованы.
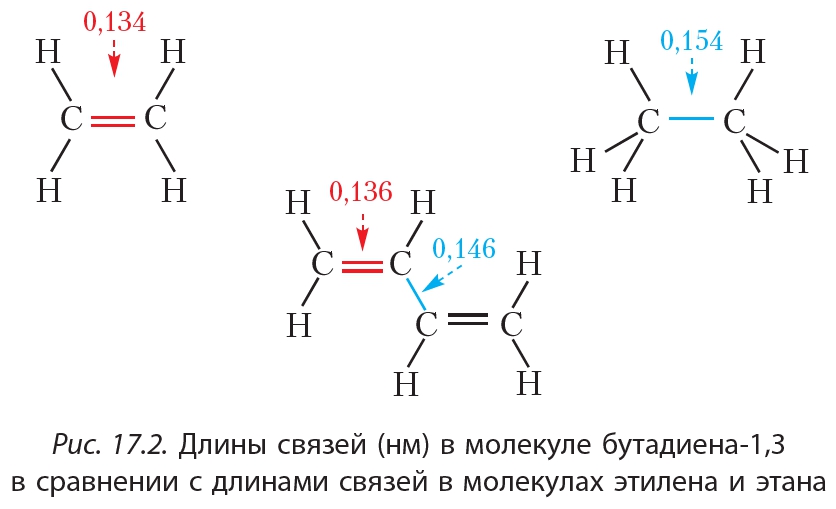
Сопряжение приводит к некоторому выравниванию длин двойных и одинарных связей в молекуле бутадиена-1,3.
Из рисунка 17.2 видно, что двойные связи в молекуле бутадиена-1,3 несколько длиннее, чем в молекуле этилена, в то время как связь ![]() в молекуле бутадиена-1,3 существенно короче, чем в молекуле этана. Эффект сопряжения оказывает влияние и на химические свойства диенов, о которых пойдёт речь ниже.
в молекуле бутадиена-1,3 существенно короче, чем в молекуле этана. Эффект сопряжения оказывает влияние и на химические свойства диенов, о которых пойдёт речь ниже.