§ 36. Элементы VА-групы. Азот і фосфар
Фосфар як простае рэчыва
Фосфар, з’яўляючыся элементам VА-групы, як і азот, здольны ўтвараць малекулу саставу P2. Аднак, у адрозненне ад малекулы азоту, двухатамная малекула фосфару няўстойлівая. Таму фосфар існуе ў выглядзе некалькіх алатропных мадыфікацый, у якіх рэалізуюцца толькі адзінарныя сувязі Р—Р: фосфар белы, чырвоны, чорны і іншыя (табл. 29).
Табліца 29. Будова і фізічныя ўласцівасці алатропных мадыфікацый фосфару
| Алатропныя мадыфікацыі фосфару | Будова | Тэмпература плаўлення | Тэмпература кіпення |
|
Р4 фосфар белы  |
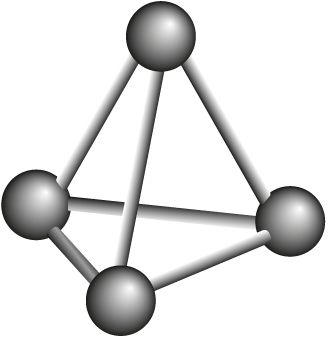 |
44 °С | 281 °С |
|
Р фосфар чырвоны  |
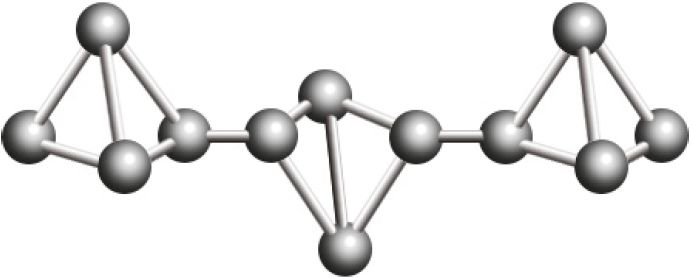 |
260 °С | ‒ Узганяецца пры тэмпературы каля 400 °С |
|
* Р фосфар чорны  |
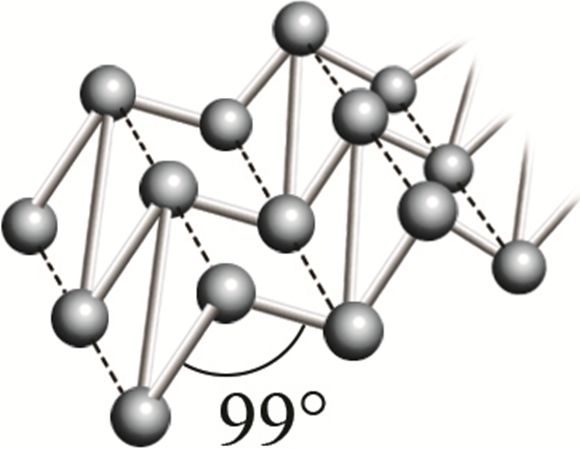
Фрагмент крышталічнай рашоткі чорнага фосфару |
Пры награванні (атмасферны ціск) ператвараецца ў чырвоны фосфар | 1000 °С (пры 1,8 ∙ 106 атм) |

Фізічныя ўласцівасці. Белы фосфар Р4 уяўляе сабой воскападобнае рэчыва з часночным пахам, атрутны. На паветры ў цемры свеціцца зеленавата-жоўтым колерам у выніку павольнай хімічнай рэакцыі акіслення (хемілюмінесцэнцыя (мал. 88)).
Чырвоны фосфар — аморфнае рэчыва палімернай будовы, не мае паху, яго таксічнасць невысокая.
Паміж алатропнымі мадыфікацыямі фосфару магчымыя ўзаемаператварэнні, якія праходзяць пры пэўных тэмпературах і цісках.
Хімічныя ўласцівасці. Як акісляльнік фосфар пры награванні ўступае ў рэакцыі з металамі, утвараючы фасфіды:
З вадародам фосфар не рэагуе.
Як адноўнік фосфар рэагуе з кіслародам і іншымі моцнымі акісляльнікамі. У чыстым кіслародзе і на паветры фосфар асляпляльна гарыць, утвараючы белы дым (часціцы цвёрдых аксідаў фосфару):
(аксід фосфару(V) у лішку кіслароду);
(аксід фосфару(III) пры нястачы кіслароду).
Белы фосфар можа самазагарацца на паветры, а чырвоны загараецца толькі пры падпальванні, што тлумачыцца рознай трываласцю хімічных сувязей паміж атамамі фосфару ў алатропных мадыфікацыях.
Фосфар атрымліваюць напальваннем сумесі фасфату кальцыю з пяском і вугалем:
Не рэагуючы з вадародам непасрэдна, фосфар, тым не менш, утварае вадародныя злучэнні. Так, фасфін можна атрымаць ускосна, напрыклад, з фасфідаў, якія разбураюцца як вадой, так і кіслотамі: Mg3Р2 + 6H2O = 3Mg(ОН)2↓ + 2РH3↑.
Фасфін РH3 — газ з часночным пахам.
У прыродзе вадародныя злучэнні фосфару сустракаюцца там, дзе адбываецца інтэнсіўнае раскладанне бялковых рэчываў.
Прымяненне. Белы фосфар выкарыстоўваюць для вытворчасці фосфарных кіслот і іх вытворных, у металургіі як кампанент некаторых гарачатрывалых сплаваў. Чырвоны фосфар выкарыстоўваюць у вытворчасці запалак, у арганічным сінтэзе (лекавыя прэпараты, ядахімікаты). Узоры фосфару, якія ўтрымліваюць нуклід 32Р («значаны атам») з перыядам паўраспаду 14,22 дзён, выкарыстоўваюць у даследчых працах.