§ 48.1. Агульная характарыстыка металаў B-груп
Асаблівасці ўласцівасцей металаў В-груп
Асаблівасць уласцівасцей злучэнняў, якія ўтвараюць d-элементы, вызначаецца электроннай будовай знешняга і перадзнешняга электронных слаёў іх атамаў.
Атамы d-элементаў B-груп на памер меншыя, чым атамы суседніх па перыядзе ns-элементаў, паколькі электроны запаўняюць унутраны энергетычны (n – 1)d-падузровень. Калі дадаткова ўлічыць, што ў атамаў d-элементаў структура знешняга электроннага слоя прыкладна аднолькавая (ns1 або ns2), то становіцца зразумелай прычына менш рэзкай змены па перыядзе ўласцівасцей d-элементаў у параўнанні з s- і р-элементамі.
Простыя рэчывы d-элементаў — тыповыя металы, што тлумачыцца параўнальна слабай сувяззю знешніх электронаў з ядром.
Удзел d-электронаў ва ўтварэнні металічнай сувязі ў простых рэчывах прыводзіць да яе ўмацавання ў параўнанні з сувяззю ў металах s- і p-элементаў. Вынікам гэтага з’яўляюцца характэрныя для раду металаў d-элементаў (напрыклад, хром, вальфрам) высокая тэмпература плаўлення (акрамя ртуці), большая шчыльнасць (выключэнне тытан), цвёрдасць. Некаторыя d-элементы (Са, Ni) з’яўляюцца ферамагнетыкамі.
Элементы IIIВ-групы, якія маюць усяго адзін d-электрон, па хімічных уласцівасцях блізкія да суседніх шчолачназямельных металаў.
Металы элементаў IVВ–VIВ-груп адрозніваюцца меншай аднаўленчай здольнасцю, а ў шэрагу выпадкаў і хімічнай пасіўнасцю. Яны больш устойлівыя да карозіі.
На паверхні пасіўных металаў большасці d-элементаў утвараецца шчыльная аксідная плёнка, якая перашкаджае працяканню розных хімічных рэакцый. Такая ўласцівасць дазваляе выкарыстоўваць гэтыя металы ў якасці антыкаразійных пакрыццяў (храміраванне, нікеліраванне, мядненне).
Большасць d-металаў стаіць у радзе актыўнасці металаў да вадароду і выцясняе вадарод з кіслот, напрыклад:
Cr + 2НСl = СrСl2 + Н2↑.
Металы Сu, Hg, Ag, Аu і металы сямейства плаціны (Ru, Rh, Pd, Os, Ir, Pt) у радзе актыўнасці размешчаныя пасля вадароду, таму не выцясняюць вадарод з кіслот. Для пераводу Сu, Hg, Ag у раствор іх акісляюць азотнай кіслатой. Au і Pt здольныя растварацца толькі ў царскай гарэлцы (сумесь канцэнтраваных азотнай і салянай кіслот) (табл. 34.2).
Табліца 34.2. Параўнанне хімічных уласцівасцей металаў s- і d-элементаў з улікам іх становішча ў радзе актыўнасці металаў
| Металы | Li | K | Са | Na | Mg | Al | Mn | Zn | Сr | Fe | Со | Ni | Sn | Pb | Н2 | Cu | Нg | Аg | Pt | Au |
| Характарыстыкі | ||||||||||||||||||||
| У прыродзе існуюць | Пераважна ў выглядзе злучэнняў | У свабодным выглядзе і ў выглядзе злучэнняў | Пераважна ў свабодным выглядзе | |||||||||||||||||
| Рэакцыі з кіслародам | Хутка | Марудна | Не акісляюцца | |||||||||||||||||
| Рэакцыі з вадой | Утварае шчолачы і Н2 | З парамі вады ўтвараюць аксіды металаў і Н2 | Не ўзаемадзейнічаюць | |||||||||||||||||
| Карозія | Каразійная ўстойлівасць узмацняецца |
|||||||||||||||||||
| Рэакцыі з кіслотамі | З раствораў кіслот-неакісляльнікаў (HСl, H2SO4(разб.), H3PO4, H2S, RCOOH) выцясняюць вадарод (Pb пасівіруецца ў разбаўленых HCl, H2SO4) |
Н2 з кіслот не выцясняюць | ||||||||||||||||||
| З разбаўленай і канцэнтраванай HNO3 утвараюць соль, ваду і прадукты аднаўлення азоту(V) З канцэнтраванай H2SO4 утвараюць соль, ваду і прадукты аднаўлення серы(VI) У канцэнтраваных HNO3 i H2SO4 металы Al, Fe, Сr, Ni пасівіруюцца |
Раствараюцца ў царскай гарэлцы HNO3 + 3HCl | |||||||||||||||||||
| Атрыманне | Электроліз расплаваў | Аднаўленне аксідаў металаў H2, СО, Al; электроліз раствораў солей; выцясненне з раствораў солей актыўнымі металамі | ||||||||||||||||||
| Злучэнне | Аксіды раствараюцца ў Н2О з утварэннем гідраксідаў | Аксіды не раствараюцца ў вадзе | ||||||||||||||||||
| Гідраксіды асноўныя | Гідраксіды і аксіды амфатэрныя | Гідраксіды і аксіды могуць быць асноўнымі, амфатэрнымі, кіслотнымі | ||||||||||||||||||
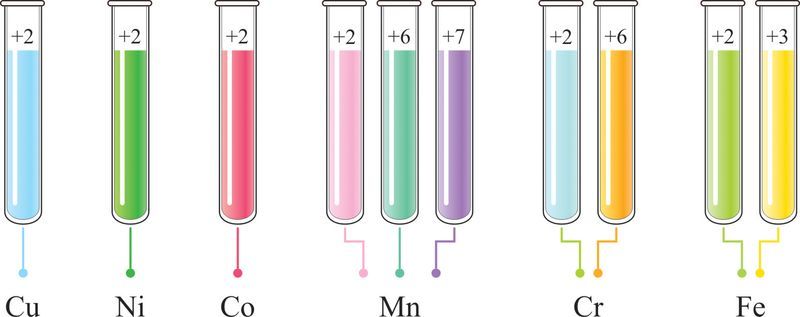
У адрозненне ад s-элементаў большасць злучэнняў d-элементаў мае спецыфічную афарбоўку, якая залежыць ад ступені акіслення іх атамаў (мал. 112.3). Напрыклад, злучэнні, утвораныя атамамі медзі ў ступені акіслення +2, пафарбаваны ў блакітны колер. Злучэнні Ni(II) маюць зялёную афарбоўку, Co(II) — ружовую, Mn(II) — бледна-ружовую, Mn(VI) — зялёную, Mn(VII) — фіялетавую, Cr(VI) — жоўтую (K2CrO4) або аранжавую (K2Cr2O7), Cr(II) — зялёную, Fe(III) — жоўтую і Fe(II) — зялёную афарбоўку.