§ 48.1. Агульная характарыстыка металаў B-груп
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 48.1. Агульная характарыстыка металаў B-груп |
| Напечатано:: | Гость |
| Дата: | Четверг, 17 Июль 2025, 14:36 |
Становішча ў перыядычнай сістэме і асаблівасці электроннай будовы атамаў металаў B-груп
Хімічныя элементы В-груп размешчаны ў перыядычнай сістэме паміж s- і р-элементамі, таму іх называюць пераходнымі элементамі.
Простыя рэчывы, утвораныя гэтымі элементамі, з’яўляюцца металамі.
На знешнім электронным слоі атамаў элементаў В-груп утрымліваецца 1–2 s-электроны. У перыядах з павелічэннем парадкавага нумара ў элементаў паслядоўна запаўняюцца электронамі d-арбіталі перадзнешняга электроннага слоя. Таму элементы В-груп адносяць да d-элементаў. З прычыны таго што існуе пяць d-арбіталей, у кожным перыядзе размешчана па дзесяць d-элементаў.
Пры пераходзе ў 4-м перыядзе ад аднаго d-элемента да наступнага спачатку запаўняюцца электронамі ns-арбіталі знешняга слоя і толькі пасля гэтага запаўняюцца (n – 1)d-арбіталі. Запаўненне ns-арбіталей павышае іх энергію, і яны на энергетычнай шкале падымаюцца вышэй за (n – 1)d-арбіталі. Таму ў формулах электронных канфігурацый d-элементаў (n – 1)d-арбіталі запісваюць перад ns-арбіталямі. Напрыклад, у Sc на 3d-арбіталі з’яўляецца электрон пасля запаўнення двума электронамі 4s-арбіталі, аднак формулу электроннай канфігурацыі Sc запісваюць [Ar]3d14s2.
Электронную канфігурацыю валентнага слоя d-элементаў 4-га перыяду можна прадставіць агульнай формулай: (n – 1)dxnsy, дзе x можа прымаць значэнні ад 1 да 10, а y роўны 1 або 2. Формулы электроннай канфігурацыі атамаў d-элементаў 4-га перыяду прыведзены ў табліцы 34.1.
Запаўненне электронамі d-арбіталей адбываецца па тых жа правілах, што і s- і р-арбіталей. Аднак у элементаў Cr і Cu адбываецца пераход, або «правал», аднаго 4s-электрона на 3d-арбіталь папярэдняга энергетычнага ўзроўню. Гэта тлумачыцца тым, што электронныя станы з канфігурацыяй 3d5 (для Cr) і 3d10 (для Cu) больш устойлівыя, а энергіі 4s- і 3d-падузроўняў адрозніваюцца нязначна, і пераход s-электрона знешняга на d-арбіталь папярэдняга электроннага слоя не патрабуе вялікіх выдаткаў энергіі.
Адрыў электронаў ад атамаў адбываецца ў зваротнай паслядоўнасці: спачатку адрываюцца ns-электроны і толькі потым (n – 1)d-электроны. Напрыклад, утварэнне іона Fe3+ можна паказаць схемай:
Fe0 – 3e– → Fe3+;
[Ar]3d64s2 – 3e– → [Ar]3d54s0.
Ступені акіслення атамаў d-элементаў у злучэннях
У адрозненне ад s- і р-элементаў у d-элементаў ва ўтварэнні хімічных сувязей могуць удзельнічаць не толькі s-электроны знешняга, але і d-электроны перадзнешняга слаёў. Гэта павялічвае колькасць магчымых ступеней іх акіслення. Акрамя d-элементаў IIIВ- і IIВ-груп, атамы ўсіх астатніх d-элементаў маюць некалькі ступеней акіслення (табл. 34.1).
З ростам парадкавага нумара элемента ў перыядзе максімальная (найвышэйшая) ступень акіслення ўзрастае ад IIIВ-групы да першага элемента VIIIВ-групы, а потым меншае. Найвышэйшая ступень акіслення ў большасці d-элементаў, як правіла, адпавядае нумару групы, да якой яны адносяцца. Выключэнне складаюць Fe, элементы падгрупы кобальту, нікелю і медзі (табл. 34.1).
Для атамаў элементаў IB-групы (Сu, Ag, Аu) магчымая не толькі ступень акіслення +1 (напрыклад, у злучэннях Cu2О, AgCl, Au2S), але і больш высокая (напрыклад, у злучэннях ,
).
Злучэнні элементаў, у якіх атамы могуць знаходзіцца ў ступені акіслення +8, вядомыя толькі для рутэнію і осмію (напрыклад, ). Для астатніх элементаў VIIIВ-групы характэрныя больш нізкія ступені акіслення.
Максімальная ступень акіслення для жалеза роўная +6 (напрыклад, у злучэнні K2FeO4). У ёй жалеза з’яўляецца моцным акісляльнікам.
Табліца 34.1. Формулы электроннай канфігурацыі, лік валентных электронаў і характэрныя ступені акіслення* атамаў 3d-элементаў
| Група | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | ||
| Элементы | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
| Ступені акіслення | +7 | |||||||||
| +6 | +6 | +6 | ||||||||
| +5 | ||||||||||
| +4 | +4 | +4 | ||||||||
| +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | |||
| +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | ||
| +1 | ||||||||||
| Электронная канфігурацыя валентнасці слоя | 3d14s2 | 3d24s2 | 3d34s2 | 3d54s1 | 3d54s2 | 3d64s2 | 3d74s2 | 3d84s2 | 3d104s1 | 3d104s2 |
*Найбольш устойлівыя ступені акіслення вылучаны колерам
Калі ў элементаў А-груп з павелічэннем парадкавага нумара па групе ўстойлівасць злучэнняў, у якіх атамы элемента праяўляюць найвышэйшую ступень акіслення, памяншаецца, то ў элементаў В-груп назіраецца зваротная заканамернасць: па групе зверху ўніз устойлівасць злучэнняў элементаў у найвышэйшай ступені акіслення атама, як правіла, павышаецца. Найвышэйшыя ступені акіслення ў злучэннях характэрныя для золата (+3), плаціны (4), осмію (+8), вальфраму (+ 6).
У нізкіх ступенях акіслення атамы d-элементаў утвараюць хімічныя сувязі, блізкія да іоннага тыпу, і ў растворах існуюць у выглядзе катыёнаў, напрыклад Mn2+, Fe2+, Ag+:
MnCl2 → Mn2+ + 2Cl–.
У найвышэйшых ступенях акіслення для d-элементаў характэрны аніённыя формы злучэнняў з кавалентным тыпам хімічнай сувязі, напрыклад у іоне .
Структурныя формулы сернай і хромавай кіслаты, у якіх атамы знаходзяцца ў аднолькавых ступенях акіслення, аднатыпныя:
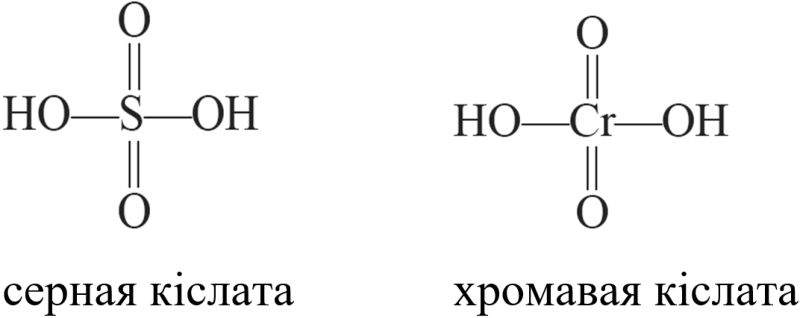
Злучэнні элементаў В-груп у найвышэйшых ступенях акіслення праяўляюць падабенства ва ўласцівасцях са злучэннямі элементаў у тых жа ступенях акіслення А-груп. У іх аналагічныя формулы аксідаў, гідраксідаў, кіслот і солей. Напрыклад, хром, элемент VIB-групы, у ступені акіслення +6 утварае кіслотны аксід CrO3 і кіслату H2CrO4, якія па саставе і акісляльнааднаўленчых уласцівасцях аналагічныя злучэнням серы, элемента VIА-групы, у той жа ступені акіслення +6: SO3 і H2SO4.
Такое падабенства характэрна для марганцу, элемента VIIB-групы, і хлору, элемента VIIА-групы. У ступені акіслення +7 марганец утварае аксід Mn2O7 малекулярная вадкасць) і адпаведную яму кіслату HMnO4. Хлор у той жа ступені акіслення (+7) утварае кіслотны аксід Cl2O7 (таксама малекулярная вадкасць) і кіслату HClO4.
Блізкасць уласцівасцей гэтых элементаў можна растлумачыць аднолькавым лікам няспараных электронаў, якія ўдзельнічаюць ва ўтварэнні хімічных сувязей з кіслародам.
| S | Cr | Cl |
| 6 | 6 | 7 |
Асаблівасці ўласцівасцей металаў В-груп
Асаблівасць уласцівасцей злучэнняў, якія ўтвараюць d-элементы, вызначаецца электроннай будовай знешняга і перадзнешняга электронных слаёў іх атамаў.
Атамы d-элементаў B-груп на памер меншыя, чым атамы суседніх па перыядзе ns-элементаў, паколькі электроны запаўняюць унутраны энергетычны (n – 1)d-падузровень. Калі дадаткова ўлічыць, што ў атамаў d-элементаў структура знешняга электроннага слоя прыкладна аднолькавая (ns1 або ns2), то становіцца зразумелай прычына менш рэзкай змены па перыядзе ўласцівасцей d-элементаў у параўнанні з s- і р-элементамі.
Простыя рэчывы d-элементаў — тыповыя металы, што тлумачыцца параўнальна слабай сувяззю знешніх электронаў з ядром.
Удзел d-электронаў ва ўтварэнні металічнай сувязі ў простых рэчывах прыводзіць да яе ўмацавання ў параўнанні з сувяззю ў металах s- і p-элементаў. Вынікам гэтага з’яўляюцца характэрныя для раду металаў d-элементаў (напрыклад, хром, вальфрам) высокая тэмпература плаўлення (акрамя ртуці), большая шчыльнасць (выключэнне тытан), цвёрдасць. Некаторыя d-элементы (Са, Ni) з’яўляюцца ферамагнетыкамі.
Элементы IIIВ-групы, якія маюць усяго адзін d-электрон, па хімічных уласцівасцях блізкія да суседніх шчолачназямельных металаў.
Металы элементаў IVВ–VIВ-груп адрозніваюцца меншай аднаўленчай здольнасцю, а ў шэрагу выпадкаў і хімічнай пасіўнасцю. Яны больш устойлівыя да карозіі.
На паверхні пасіўных металаў большасці d-элементаў утвараецца шчыльная аксідная плёнка, якая перашкаджае працяканню розных хімічных рэакцый. Такая ўласцівасць дазваляе выкарыстоўваць гэтыя металы ў якасці антыкаразійных пакрыццяў (храміраванне, нікеліраванне, мядненне).
Большасць d-металаў стаіць у радзе актыўнасці металаў да вадароду і выцясняе вадарод з кіслот, напрыклад:
Cr + 2НСl = СrСl2 + Н2↑.
Металы Сu, Hg, Ag, Аu і металы сямейства плаціны (Ru, Rh, Pd, Os, Ir, Pt) у радзе актыўнасці размешчаныя пасля вадароду, таму не выцясняюць вадарод з кіслот. Для пераводу Сu, Hg, Ag у раствор іх акісляюць азотнай кіслатой. Au і Pt здольныя растварацца толькі ў царскай гарэлцы (сумесь канцэнтраваных азотнай і салянай кіслот) (табл. 34.2).
Табліца 34.2. Параўнанне хімічных уласцівасцей металаў s- і d-элементаў з улікам іх становішча ў радзе актыўнасці металаў
| Металы | Li | K | Са | Na | Mg | Al | Mn | Zn | Сr | Fe | Со | Ni | Sn | Pb | Н2 | Cu | Нg | Аg | Pt | Au |
| Характарыстыкі | ||||||||||||||||||||
| У прыродзе існуюць | Пераважна ў выглядзе злучэнняў | У свабодным выглядзе і ў выглядзе злучэнняў | Пераважна ў свабодным выглядзе | |||||||||||||||||
| Рэакцыі з кіслародам | Хутка | Марудна | Не акісляюцца | |||||||||||||||||
| Рэакцыі з вадой | Утварае шчолачы і Н2 | З парамі вады ўтвараюць аксіды металаў і Н2 | Не ўзаемадзейнічаюць | |||||||||||||||||
| Карозія | Каразійная ўстойлівасць узмацняецца |
|||||||||||||||||||
| Рэакцыі з кіслотамі | З раствораў кіслот-неакісляльнікаў (HСl, H2SO4(разб.), H3PO4, H2S, RCOOH) выцясняюць вадарод (Pb пасівіруецца ў разбаўленых HCl, H2SO4) |
Н2 з кіслот не выцясняюць | ||||||||||||||||||
| З разбаўленай і канцэнтраванай HNO3 утвараюць соль, ваду і прадукты аднаўлення азоту(V) З канцэнтраванай H2SO4 утвараюць соль, ваду і прадукты аднаўлення серы(VI) У канцэнтраваных HNO3 i H2SO4 металы Al, Fe, Сr, Ni пасівіруюцца |
Раствараюцца ў царскай гарэлцы HNO3 + 3HCl | |||||||||||||||||||
| Атрыманне | Электроліз расплаваў | Аднаўленне аксідаў металаў H2, СО, Al; электроліз раствораў солей; выцясненне з раствораў солей актыўнымі металамі | ||||||||||||||||||
| Злучэнне | Аксіды раствараюцца ў Н2О з утварэннем гідраксідаў | Аксіды не раствараюцца ў вадзе | ||||||||||||||||||
| Гідраксіды асноўныя | Гідраксіды і аксіды амфатэрныя | Гідраксіды і аксіды могуць быць асноўнымі, амфатэрнымі, кіслотнымі | ||||||||||||||||||
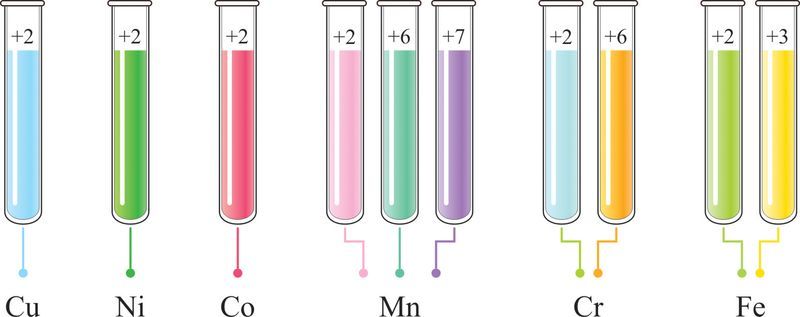
У адрозненне ад s-элементаў большасць злучэнняў d-элементаў мае спецыфічную афарбоўку, якая залежыць ад ступені акіслення іх атамаў (мал. 112.3). Напрыклад, злучэнні, утвораныя атамамі медзі ў ступені акіслення +2, пафарбаваны ў блакітны колер. Злучэнні Ni(II) маюць зялёную афарбоўку, Co(II) — ружовую, Mn(II) — бледна-ружовую, Mn(VI) — зялёную, Mn(VII) — фіялетавую, Cr(VI) — жоўтую (K2CrO4) або аранжавую (K2Cr2O7), Cr(II) — зялёную, Fe(III) — жоўтую і Fe(II) — зялёную афарбоўку.
Металы В-груп адносяць да d-элементаў з агульнай электроннай канфігурацыяй валентнага слоя (n – 1)dxnsy, дзе x можа прымаць значэнні ад 1 да 10.
Пры ўтварэнні хімічных сувязей у атамах d-элементаў удзельнічаюць не толькі s-электроны знешняга, але і d-электроны перадзнешняга слаёў.
Акрамя d-элементаў IIIВ- і IIВ-груп, атамы ўсіх астатніх d-элементаў маюць некалькі ступеней акіслення. Найвышэйшая ступень акіслення атамаў, як правіла, адпавядае нумару групы d-элемента.
У нізкіх ступенях акіслення атамы d-элементаў утвараюць хімічныя сувязі, блізкія да іоннага тыпу, і ў растворах існуюць у выглядзе катыёнаў.
У найвышэйшых ступенях акіслення для d-элементаў характэрны аніённыя формы злучэнняў.
Пытанні, заданні, задачы
1. Прывядзіце формулы і схемы электронных канфігурацый атама марганцу ў наступных ступенях акіслення: 0, +2, +4, +6, +7.
2. Растлумачце эфект «правалу» электрона ў электронных канфігурацыях медзі і хрому.
3. Выкарыстоўваючы інтэрнэт-рэсурсы, складзіце табліцу атамных радыусаў элементаў 4-га перыяду і растлумачце характар іх змены.
4. Электроны якога энергетычнага ўзроўню прынята лічыць валентнымі ў d-элементаў?
5. Параўнайце электронную будову атамаў элементаў А- і В-груп:
- а) лік валентных электронаў;
- б) лік валентных атамных арбіталей;
- в) максімальная ступень акіслення.
6. Чаму ў d-элементаў па перыядзе ўласцівасці змяняюцца не так рэзка, як у s- і р-элементаў?
7. Укажыце ўзаемасувязь ступені акіслення d-элементаў з іх здольнасцю ўтвараць катыённыя і аніённыя формы злучэнняў?
8. Між хлорам і марганцам у найвышэйшай ступені акіслення існуе пэўнае падабенства: у ступені акіслення +7 хлор і марганец утвараюць кіслоты, аднолькавыя па саставе: HClO4 і HMnO4 адпаведна. Пакажыце структурныя формулы гэтых кіслот.
9. Складзіце ўраўненні рэакцый паводле схемы:
Cu → Cu(NO3)2 → CuS → Cu(NO3)2 → CuO → СH3CHO.
10. Праз раствор сульфату медзі(II) аб'ёмам 1 дм3 з масавай доляй солі 18 % (ρ = 1,2 г/см3) прапусцілі 23,3 дм3 серавадароду (н. у.). Вызначце масу асадку і масавыя долі рэчываў у растворы.
Самакантроль
1. Электронную канфігурацыю валентнага слоя d-элементаў можна прадставіць агульнай формулай:
- а) (n – 1)dxnsy;
- б) ndx(n − 1)sy;
- в) ndx;
- г) nsx.
2. Правільнымі з’яўляюцца сцвярджэнні:
- а) з ростам парадкавага нумара элемента ў перыядзе найвышэйшая ступень акіслення ўзрастае ад IIIВ-групы да першага элемента VIIIВ-групы, а потым меншае;
- б) найвышэйшая ступень акіслення ў большасці d-элементаў, як правіла, адпавядае нумару групы, да якой яны адносяцца;
- в) у нізкіх ступенях акіслення атамы d-элементаў утвараюць хімічныя сувязі, блізкія да іоннага тыпу;
- г) злучэнні элементаў В-груп у найвышэйшых ступенях акіслення падобныя ва ўласцівасцях з злучэннямі элементаў у тых жа ступенях акіслення А-груп.
3. Адзін s-электрон на знешнім слоі ў асноўным стане ўтрымліваюць атамы:
- а) V;
- б) Cr;
- в) Ni;
- г) Cu.
4. Электронная канфігурацыя атама жалеза:
- а) 3d64s2;
- б) 3d64s1;
- в) 3d54s2;
- г) 3d74s2.
5. Марганцу ў найвышэйшай ступені акіслення адпавядаюць абодва злучэнні ў парах:
- а) Н2MnO4 і Мn2O7;
- б) KMnO4 і Мn2O7;
- в) NaMnO4 і HМnO4;
- г) KMnO4 і МnO2.