§ 45. Агульныя спосабы атрымання металаў
Электрахімічныя метады
Электрахімічны метад атрымання металаў (электраметалургія) заключаеццца ў вылучэнні металаў з руд электролізам. Электроліз — гэта акісляльнааднаўленчы працэс, які працякае пад дзеяннем пастаяннага электрычнага току, які праходзіць праз раствор або расплаў электраліту.
Яго адрозненне ад звычайных акісляльна-аднаўленчых рэакцый у тым, што працэсы акіслення і аднаўлення падзеленыя ў прасторы і працякаюць на электродах, змешчаных у раствор або расплаў электраліту.
Працэс атрымання металаў электролізам праводзяць у спецыяльных апаратах, так званых электралізёрах. У іх ёсць крыніца электрычнага сілкавання, злучаная з электродамі, якія пагружаны ў ванну з токаправодным водным растворам або расплавам солі металу.
Выбар умоў правядзення электролізу і саставу электраліту вызначаецца становішчам металу ў радзе актыўнасці. Электролізам воднага раствору можна атрымаць толькі тыя металы, якія знаходзяцца ў радзе актыўнасці правей алюмінію (напрыклад, Zn, Ni, Sn, Cr, Pb, Co, Cu, Ag, Au, Pd і інш.). Алюміній, магній, шчолачныя і шчолачназямельныя металы, тытан атрымліваюць электролізам расплаваў іх аксідаў або хларыдаў.
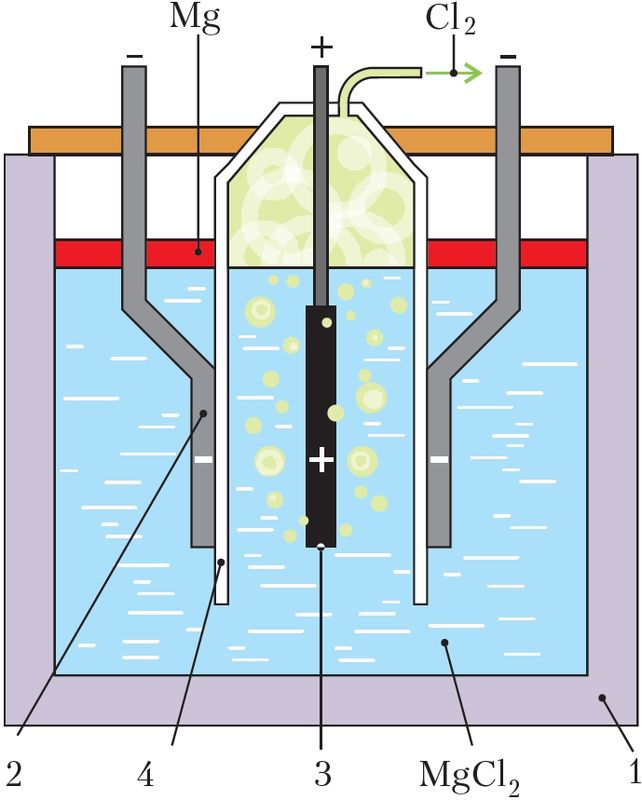
Разгледзім працэс электролізу на прыкладзе атрымання магнію з яго хларыду (мал. 108).
Ванну электралізёра (1) запаўняюць расплаўленым MgCl2. Для зніжэння яго тэмпературы плаўлення і павышэння электраправоднасці расплаву ў яго ўводзяць NаСl, СаСl2, KСl і невялікія колькасці NaF і СаF2. Тэмпературу падтрымліваюць у межах 720 °С. У гэтых умовах хларыд магнію і іншыя солі дысацыіруюць на іоны:
На катодзе — электродзе, падключаным да адмоўнага полюса крыніцы пастаяннага току (2), працякаюць працэсы аднаўлення — перадача электронаў ад катода катыёнам магнію:
Іншыя металы пры зададзеных умовах электролізу не аднаўляюцца, таму што канцэнтрацыя іх іонаў невялікая.
Металічны магній, які вылучаецца на катодзе, усплывае ў катоднай прасторы на паверхню электраліту, паколькі шчыльнасць магнію меншая за шчыльнасць электраліту-расплаву. Магній перыядычна выдаляюць з дапамогай вакуумнага каўша.
На анодзе — электродзе, падключаным да дадатнага полюса крыніцы пастаяннага току (3), працякаюць працэсы акіслення — электроны пераходзяць ад аніёнаў да электрода:
Катодная і анодная прастора электраліту падзелена перагародкай (4), каб хлор, які вылучаецца, не акісляў магній і выдаляўся з электралізёра.