§ 45. Агульныя спосабы атрымання металаў
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 45. Агульныя спосабы атрымання металаў |
| Напечатано:: | Гость |
| Дата: | Saturday, 25 October 2025, 13:35 |
Значная хімічная актыўнасць металаў з’яўляецца прычынай таго, што ў зямной кары яны існуюць, як было адзначана раней, пераважна ў выглядзе злучэнняў — мінералаў.
Горныя пароды (навалы мінералаў), з якіх тэхналагічна можна і эканамічна выгадна здабываць валавым спосабам метал, называюць рудой. Руда практычна ніколі не ўтрымлівае злучэнні металу ў чыстым выглядзе, у ёй заўсёды прысутнічаюць прымесі іншых мінералаў, якія называюць пустой пародай. Таму праблемай з’яўляецца не толькі распрацоўка тэхналогіі здабывання металаў з мінералаў, але і пошук спосабаў ачысткі мінералаў ад пустой пароды. Сучасныя тэхналогіі робяць эканамічна выгаднай здабычу жалеза з руд, у якіх яго колькасць складае 30–55 %; цынку — 2–6 %; волава — 0,2–2 %; золата — 0,00002–0,0002 %.
Вобласць навукі і тэхнікі, галіну прамысловасці, звязаную з дабываннем металаў з руд і атрыманнем іх у выглядзе, прыдатным для выкарыстання, называюць металургіяй.
Металургічныя працэсы прынята падзяляць на тры этапы.
Першы этап — папярэдняя апрацоўка руды. На гэтым этапе ажыццяўляюць узбагачэнне руды — аддзяленне ўсіх каштоўных мінералаў ад пустой пароды. Калі рудой з’яўляецца сульфід металу (CuFeS2, PbS, ZnS і інш.), то такую руду папярэдне абпальваюць у прысутнасці кіслароду для пераводу металаў у аксіды:
Другі этап — аднаўленне металаў з іх злучэнняў: аксідаў ці солей. Метады аднаўлення можна падзяліць на тры вялікія групы: піраметалургічныя, электрахімічныя і гідраметалургічныя.
На трэцім этапе праводзяць ачыстку металаў — рафінаванне.
Метад атрымання металу з яго руды выбіраюць з улікам уласцівасцей злучэнняў металу і яго хімічнай актыўнасці.
Піраметалургічныя метады
Піраметалургічныя метады атрымання металаў заснаваны на аднаўленні металаў з іх руд пры высокай тэмпературы рознымі рэчывамі з аднаўленчымі ўласцівасцямі. Найбольш распаўсюджаныя адноўнікі — вугаль, аксід вугляроду(II), вадарод, алюміній. У якасці прыкладаў прывядзём рэакцыі, якія выкарыстоўваюцца для атрымання металаў як у прамысловасці, так і ў лабараторыі: рэакцыі аднаўлення цынку вугалем і аксідам вугляроду(II), медзі і вальфраму — вадародам, жалеза і хрому — алюмініем:
Разгледзім больш падрабязна працэс атрымання жалеза ў саставе яго сплаваў — чыгуну і сталі.
Асноўная крыніца жалеза — гэта руды, якія змяшчаюць такія мінералы, як магнетыт (Fe3O4) і гематыт (Fe2О3). Карыснымі прымесямі, якія паляпшаюць якасць выплаўленага з руды жалеза, з’яўляюцца злучэнні Mn, Ni, Co, Сr, B, V. Іх называюць легіравальнымі дадаткамі. Злучэнні As, P, S, Pb, Zn — шкодныя прымесі, якія пагаршаюць уласцівасці жалеза.
У цяперашні час у вытворчасці сталі выкарыстоўваюць два асноўныя спосабы.
Паводле першага традыцыйнага спосабу атрыманне сталі праводзяць у дзве стадыі. На першай з іх атрымліваюць чыгун, які на другой стадыі перапрацоўваюць у сталь.

Для атрымання чыгуну жалеза аднаўляюць вугляродам і чадным газам, які ўтвараецца пры няпоўным згаранні вугалю. У доменную печ загружаюць сумесь жалезнай руды, спецыяльна апрацаванага вугалю, так званага коксу, і дадаюць для паніжэння тэмпературы плаўлення вапняк.
Такую сумесь, якая мае назву «шыхта», уводзяць у доменную печ зверху, адкуль яна перамяшчаецца ўніз у зону больш высокатэмпературнага награвання, дзе тэмпература падымаецца да 1600 °С і сумесь расплаўляецца.
Удзіманае знізу ў доменную печ паветра забяспечвае гарэнне вугляроду з вылучэннем вялікай колькасці цеплаты і ўтварэннем чаднага газу, які аднаўляе жалеза з яго аксідаў. Адноўленае жалеза ўжо пры тэмпературы каля 1000 °С навугляроджваецца і ўтвараецца сплаў — чыгун. У ім, акрамя жалеза, утрымліваюцца графіт і цэментыт — карбід жалеза Fe3C з сумарным утрыманнем вугляроду прыблізна ад 2 да 6 %.
Расплаў чыгуну перыядычна выдаляюць, ізалюючы яго ад шлаку. Хімічныя працэсы, якія праходзяць у розных зонах доменнай печы, адлюстраваны на малюнку.
Пры перапрацоўцы чыгуну ў сталь на другой стадыі працэсу залішні вуглярод, а нярэдка і іншыя прымесі, напрыклад крэмнію, фосфару, серы, акісляюць пры высокай тэмпературы кіслародам паветра. Для гэтага выкарыстоўваюць розныя ўстаноўкі — мартэнаўскія печы, канвертары, электрапечкі. Аксіды неметалаў, якія ўтвараюцца, усплываюць у выглядзе шлаку або выпараюцца. Разам з акісленнем прымесей адбываецца таксама частковае акісленне жалеза з утварэннем аксіду жалеза(II), які раствараецца ў расплавах чыгуну і сталі. Аксід жалеза(II) аднаўляюць, дадаючы ў расплаў крэмній, марганец або алюміній у якасці адноўнікаў. Шлак, што ўтвараецца з аксідаў, аддзяляюць ад расплаву жалеза.
Другі спосаб вытворчасці сталі аднастадыйны, яго называюць прамым. У ім стадыя атрымання чыгуну адсутнічае, меншы выкід вуглякіслага газу ў атмасферу. З’яўляючыся больш эканамічным, ён паступова выцясняе першы спосаб. Для атрымання сталі жалезную руду здрабняюць, а потым абпальваюць з адносна невялікай колькасцю коксу ў печах, якія верцяцца. Атрыманыя жалезарудныя акатышы, якія змяшчаюць аксіды жалеза, падвяргаюць уздзеянню газападобнага адноўніку ў спецыяльных рэактарах.
У якасці адноўніку выкарыстоўваюць сумесь метану, аксіду вугляроду(II) і вадароду. Вадарод і аксід вугляроду(II) утвараюцца з метану пры яго акісленні кіслародам у прысутнасці каталізатара ў спецыяльных апаратах па рэакцыі:
Утварэнне металічнага жалеза можна адлюстраваць ураўненнямі рэакцый:
Атрыманае пры аднаўленні губчатае жалеза (акатышы) падвяргаецца пераплаўленню ў электрадугавых печах. Пры гэтым, уводзячы неабходныя дабаўкі, жалеза легіруюць для атрымання таго ці іншага гатунку высакаякасных сталей — каразійнаўстойлівых, інструментальных, канструкцыйных, электратэхнічных, гарачатрывалых і інш.
Электрахімічныя метады
Электрахімічны метад атрымання металаў (электраметалургія) заключаеццца ў вылучэнні металаў з руд электролізам. Электроліз — гэта акісляльнааднаўленчы працэс, які працякае пад дзеяннем пастаяннага электрычнага току, які праходзіць праз раствор або расплаў электраліту.
Яго адрозненне ад звычайных акісляльна-аднаўленчых рэакцый у тым, што працэсы акіслення і аднаўлення падзеленыя ў прасторы і працякаюць на электродах, змешчаных у раствор або расплаў электраліту.
Працэс атрымання металаў электролізам праводзяць у спецыяльных апаратах, так званых электралізёрах. У іх ёсць крыніца электрычнага сілкавання, злучаная з электродамі, якія пагружаны ў ванну з токаправодным водным растворам або расплавам солі металу.
Выбар умоў правядзення электролізу і саставу электраліту вызначаецца становішчам металу ў радзе актыўнасці. Электролізам воднага раствору можна атрымаць толькі тыя металы, якія знаходзяцца ў радзе актыўнасці правей алюмінію (напрыклад, Zn, Ni, Sn, Cr, Pb, Co, Cu, Ag, Au, Pd і інш.). Алюміній, магній, шчолачныя і шчолачназямельныя металы, тытан атрымліваюць электролізам расплаваў іх аксідаў або хларыдаў.
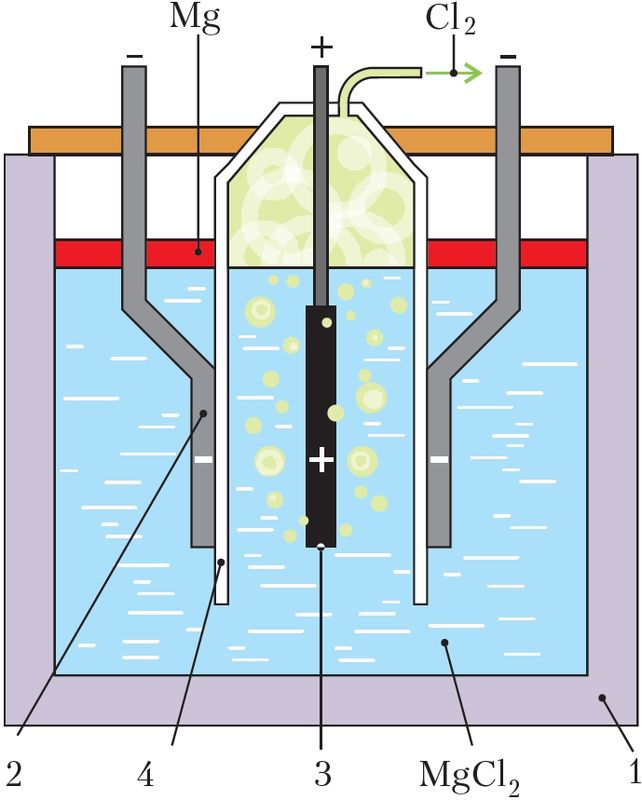
Разгледзім працэс электролізу на прыкладзе атрымання магнію з яго хларыду (мал. 108).
Ванну электралізёра (1) запаўняюць расплаўленым MgCl2. Для зніжэння яго тэмпературы плаўлення і павышэння электраправоднасці расплаву ў яго ўводзяць NаСl, СаСl2, KСl і невялікія колькасці NaF і СаF2. Тэмпературу падтрымліваюць у межах 720 °С. У гэтых умовах хларыд магнію і іншыя солі дысацыіруюць на іоны:
На катодзе — электродзе, падключаным да адмоўнага полюса крыніцы пастаяннага току (2), працякаюць працэсы аднаўлення — перадача электронаў ад катода катыёнам магнію:
Іншыя металы пры зададзеных умовах электролізу не аднаўляюцца, таму што канцэнтрацыя іх іонаў невялікая.
Металічны магній, які вылучаецца на катодзе, усплывае ў катоднай прасторы на паверхню электраліту, паколькі шчыльнасць магнію меншая за шчыльнасць электраліту-расплаву. Магній перыядычна выдаляюць з дапамогай вакуумнага каўша.
На анодзе — электродзе, падключаным да дадатнага полюса крыніцы пастаяннага току (3), працякаюць працэсы акіслення — электроны пераходзяць ад аніёнаў да электрода:
Катодная і анодная прастора электраліту падзелена перагародкай (4), каб хлор, які вылучаецца, не акісляў магній і выдаляўся з электралізёра.
Гідраметалургічныя метады
Гідраметалургія — гэта атрыманне металаў з руд, канцэнтратаў і адходаў вытворчасці з дапамогай водных раствораў пэўных рэчываў (хімічных рэагентаў).
Спачатку металы пераводзяць у растваральныя злучэнні. Потым іх аднаўляюць, выкарыстоўваючы або хімічныя рэакцыі з моцнымі адноўнікамі, або працэсы выцяснення металаў з раствораў іх солей больш актыўнымі металамі, або электрахімічнае аднаўленне з раствораў.
Напрыклад, гідраметалургічным метадам атрымліваюць медзь з раствораў яе солей з дапамогай жалеза:
Серабро і золата аднаўляюць з раствораў солей гэтых металаў цынкам. Пакрыцці з нікелю і цынку атрымліваюць электролізам раствораў іх солей.
Працэсы здабывання золата з абедненых руд можна апісаць наступнымі ўраўненнямі рэакцый:
4Au + 8KCN + O2 + 2H2O = 4K[Au(CN)2] + 4KOH;
2K[Au(CN)2] + Zn = K2[Zn(CN)4] + 2Au.
Прадпрыемства «Унікаштмет БДУ» перапрацоўвае розны лом i адходы, якiя ўтрымліваюць каштоўныя металы (мал. 108.1), вылучаючы растварэннем іх у сумесі з 1 аб’ёму азотнай і 3 аб’ёмаў сернай канцэнтраваных кіслот. Такую сумесь называюць «царскай гарэлкай». Растварэнне золата можна апісаць ураўненнем рэакцыі
Au + HNO3 + 3HCl = AuCl3 + NO↑ + 2H2O↑.
За 2000–2020 гады ў Дзяржфонд Рэспублікі Беларусь прадпрыемствам пастаўлена больш за 72 тоны золата, серабра, плаціны і іншых каштоўных металаў.

Металургія — вобласць навукі і галіна прамысловасці, звязаная з дабываннем металаў з руд і атрыманнем іх у выглядзе, прыдатным для выкарыстання.
Металы атрымліваюць аднаўленнем з іх злучэнняў:
- • метадам піраметалургіі, выкарыстоўваючы ў якасці адноўнікаў вугаль, вадарод, аксід вугляроду(II), больш актыўны метал (напрыклад, алюміній) пры высокай тэмпературы;
- • электрахімічным метадам з раствораў або з расплаваў солей металаў, выкарыстоўваючы для аднаўлення электрычны ток;
- • гідраметалургічным метадам аднаўлення металаў з раствораў іх солей больш актыўнымі металамі.
Электроліз — гэта акісляльна-аднаўленчы працэс, што працякае на электродах пад дзеяннем пастаяннага электрычнага току, які праходзіць праз раствор або расплаў электраліту.
Пытанні, заданні, задачы
1. Выкарыстоўваючы даныя пра тэмпературы плаўлення металаў і сплаваў (§ 43), выкажыце меркаванне, чаму першымі металамі, здабытымі чалавекам, былі золата, серабро, медзь і толькі потым жалеза.
2. Складзіце ўраўненні рэакцый абпалу сульфідных руд, якія ўтрымліваюць мінералы CuS, Cu2S, ZnS, FeS2.
3. Складзіце ўраўненні рэакцый аднаўлення аксідаў металаў Fe3O4, Fe2O3, FeO, PbO, ZnO аксідам вугляроду(II).
4. Складзіце ўраўненні рэакцый атрымання металаў алюматэрмічным спосабам (аднаўленне алюмініем) з іх аксідаў: МnO2, Cr2O3, Fe3O4.
5. Разлічыце і параўнайце масавую долю медзі ў мінералах халькапірыт СuFeS2 і малахіт (CuOH)2CO3.
6. Прывядзіце ўраўненні рэакцый, якія праходзяць на электродах у працэсе атрымання натрыю электролізам расплаву яго хларыду.

7. У дэталях мабільнага тэлефона змяшчаецца каля 0,050 г золата. Колькі трэба перапрацаваць тэлефонаў, каб атрымаць 1 кг золата? Выхад прадукту пры перапрацоўцы складае 98 %.
8. Складзіце ўраўненні рэакцый паводле схемы:
дзе Х — складанае рэчыва, Y — простае рэчыва.
9. На тэрыторыі цяперашняй Рэспублікі Беларусь даўней жалеза атрымлівалі з балотнай, азёрнай і дзярновай руды. Гэтая руда ўяўляе сабой буры жалязняк, які складаецца з гематыту (Fe2O3) і ліманіту (спрошчаная формула FeOOH). Прапануйце спосаб, які мог быць выкарыстаны ў той час для атрымання жалеза.
10. Вылічыце масу чыгуну з масавай доляй жалеза 94 %, які можна атрымаць з 10 тон магнітнага жалезняку з масавай доляй Fe3O4 24 %.
*Самакантроль
1. Справядлівымі з’яўляюцца сцвярджэнні:
- а) металургія — гэта і сфера навукі, і галіна прамысловасці;
- б) узбагачэнне руды — гэта аддзяленне пэўных мінералаў ад пустой пароды;
- в) пры абпале руды ўтвараюцца, як правіла, солі;
- г) найбольш распаўсюджаныя ў металургіі адноўнікі — С, СО, Н2, электрычны ток.
2. Аднаўленне жалеза магчымае ў выпадку ўзаемадзеяння:
- а) Fe3O4 і HCl;
- б) Fe2O3 і C;
- в) FeO і H2;
- г) Fe2O3 і СаО.
3. Пры атрыманні металаў электролізам катоднымі працэсамі з’яўляюцца:
- а) 2Сl– – 2e– = Cl2↑;
- б) Mg2+ + 2e– = Mg0;
- в) Na+ + e– = Na0;
- г) 4ОН– – 4e– = 2Н2О + О2↑.
4. Да гідраметалургічных метадаў атрымання металаў можна аднесці працэс:
- а) СuSO4(р-р) + Fe →;
- б) Fe2O3 + Al →;
- в) FeO + CO →;
- г) NiCl2(р-р)
.
5. Масавая доля жалеза ў чыгуне складае 94 %. Утрыманне вугляроду ў ім:
- а) 7 %;
- б) 1,0–1,5 %;
- в) 6 %;
- г) менш за 6 %.