§ 37. Аміяк
Солі амонію
Рэакцыі аміяку з кіслотамі дазваляюць атрымаць разнастайныя солі амонію.
Солі амонію ўяўляюць сабой цвёрдыя крышталічныя рэчывы, добра растваральныя ў вадзе. Іх растворы з’яўляюцца моцнымі электралітамі, што дысацыіруюць з утварэннем катыёна амонію і аніёна кіслотнага астатку:
Найважнейшая асаблівасць солей амонію — узаемадзеянне са шчолачамі з вылучэннем аміяку:
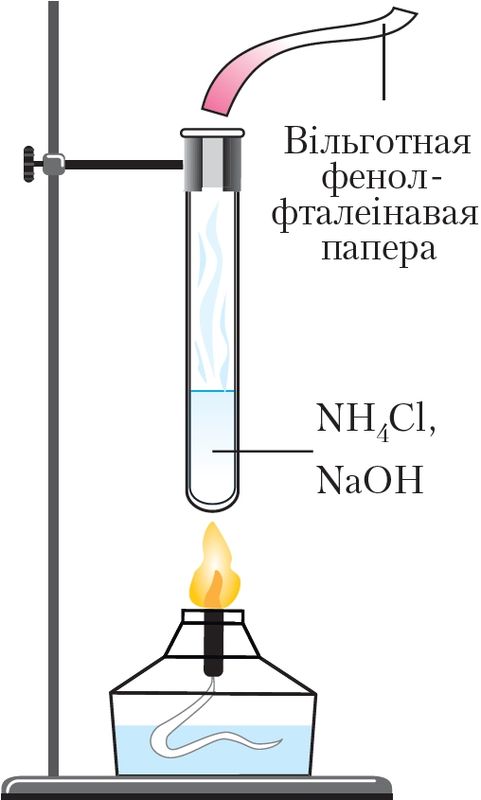
Узаемадзеянне солей амонію са шчолачамі пры награванні выкарыстоўваюць для выяўлення іонаў амонію (якасная рэакцыя на іон ). Для гэтага да награванай сумесі падносяць вільготную індыкатарную паперку. У прысутнасці аміяку фенолфталеінавая папера становіцца малінавай, лакмусавая — сіняй (мал. 93, рис. 93, Дадатак 3).
Другой асаблівасцю солей амонію з’яўляецца іх тэрмічная няўстойлівасць.
Раскладанне кожнай з солей амонію спецыфічнае. Так, шырока ўжываныя ў якасці разрыхляльнікаў для цеста карбанат і гідракарбанат амонію (харчовая дабаўка Е503) раскладаюцца ўжо пры невялікім награванні з утварэннем аміяку, вуглякіслага газу і вады:
(NH4)2СO3 2NH3 + СО2 + Н2О;
NH4НСO3 NH3 + СО2 + Н2О.
Хларыд амонію раскладаецца на аміяк і хлоравадарод:
NH4Cl NH3 + HCl.
Прымяненне аміяку і солей амонію. Асноўная частка вырабленага аміяку ідзе на вытворчасць угнаенняў (аміячная салетра NH4NO3, сульфат амонію (NH4)2SO4, мачавіна (NH2)2СO і інш.) і азотнай кіслаты. Аміяк запатрабаваны ў вытворчасці соды, фарбавальнікаў, палімераў. Яго выкарыстоўваюць у жывёлагадоўлі для павышэння ўтрымання азоту ў кармах. Аміячную ваду (18–25%-ны водны раствор) ужываюць як вадкае ўгнаенне. Нашатырны спірт (водны раствор аміяку з масавай доляй 3–10 %) выкарыстоўваюць у медыцыне. У побыце нашатырны спірт ужываюць для вывядзення плям з адзежы, пры чыстцы посуду, сантэхнікі, ювелірных упрыгажэнняў, для мыцця шкла і крышталю.
Не варта блытаць нашатырны спірт (NH3 ∙ H2O) з нашатыром — соллю і мінералам складу NH4Cl.
Нашатыр ужываюць у якасці ўгнаення на нейтральных і шчолачных глебах, выкарыстоўваюць як флюс для выдалення аксіднай плёнкі пры пайцы металаў, у гальванічных элементах як кампанент электраліту (мал. 94), карбанат і гідракарбанат амонію выкарыстоўваюць у якасці разрыхляльнікаў для цеста пры выпечцы.
