§ 37. Аміяк
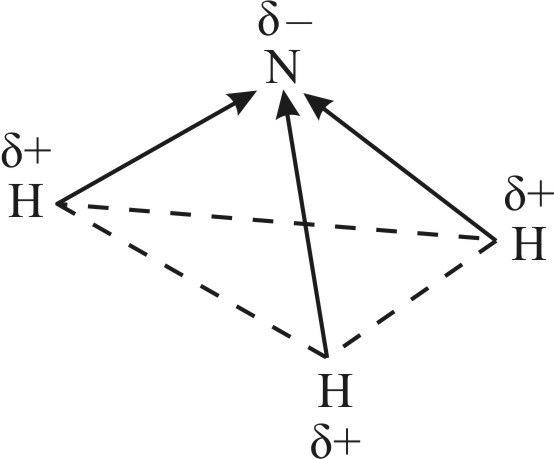
Вадароднае злучэнне азоту аміяк — рэчыва малекулярнай будовы. Яго структурная формула ![]() . У малекуле аміяку, як паказана ў § 13, тры адзінарныя кавалентныя палярныя сувязі, утвораныя па абменным механізме. Электронная шчыльнасць зрушана да атама азоту, у якога ёсць непадзеленая пара s-электронаў. Таму малекула аміяку палярная і мае канфігурацыю трыганальнай піраміды (мал. 89).
. У малекуле аміяку, як паказана ў § 13, тры адзінарныя кавалентныя палярныя сувязі, утвораныя па абменным механізме. Электронная шчыльнасць зрушана да атама азоту, у якога ёсць непадзеленая пара s-электронаў. Таму малекула аміяку палярная і мае канфігурацыю трыганальнай піраміды (мал. 89).
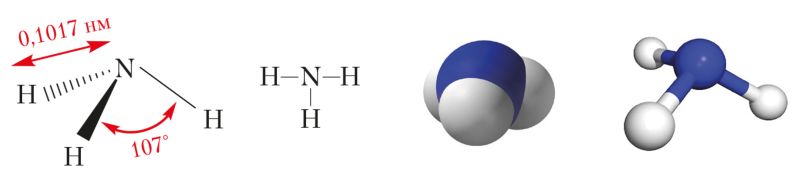
Узаемнае адштурхоўванне атамаў вадароду прыводзіць да павелічэння валентнасці вугла паміж напрамкамі кавалентных сувязей N—H ад 90° да 107°.
Будова малекулы аміяку. Форма піраміды ў малекуле аміяку і валентны вугал 107° пры яе вяршыні тлумачацца ўтварэннем сувязей паміж гібрыднымі арбіталямі атама азоту і s-арбіталямі атама вадароду.
Згодна з канцэпцыяй гібрыдызацыі, ва ўтварэнні кавалентных сувязей удзельнічаюць не зыходныя валентныя тры 2p-арбіталі знешняга электроннага ўзроўню атама азоту, а тры з чатырох sp3-гібрыдных арбіталей, схема ўтварэння якіх паказана на малюнку 89.1 (а–г).
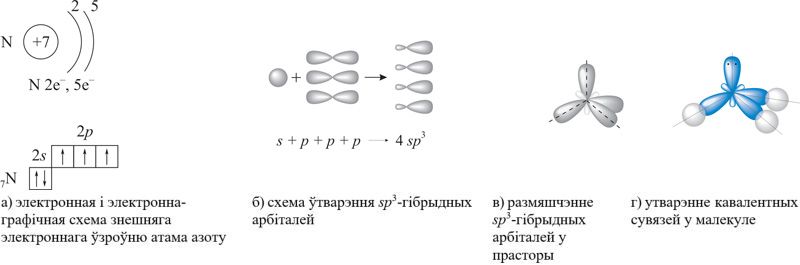
Непадзеленая электронная пара чацвёртай гібрыднай арбіталі валодае нязначнай адштурхоўвальнай сілай, што тлумачыць памяншэнне валентнасці вугла H—N—H з 109,5° да 107. Размяшчэнне трох кавалентных палярных сувязей пад вуглом прыводзіць да асіметрычнага размеркавання электроннай шчыльнасці, гэта значыць да палярнасці малекулы:
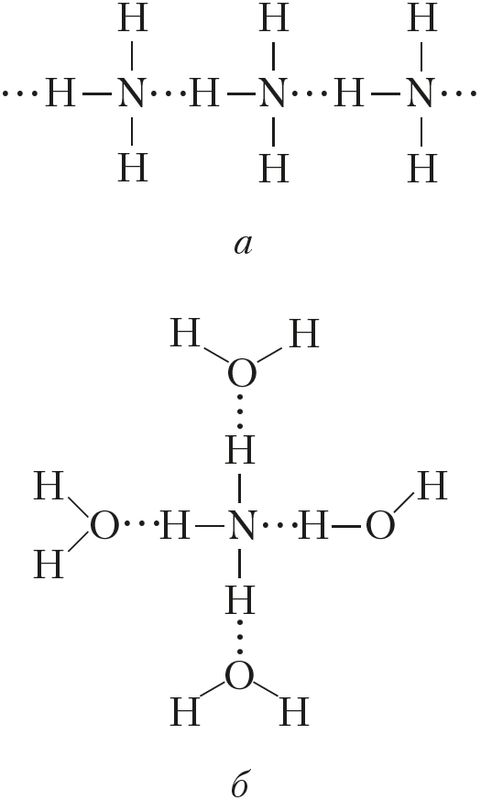
Фізічныя ўласцівасці. Аміяк — бясколерны газ (н. у.) з характэрным рэзкім пахам (пах нашатырнага спірту). Ён добра раствараецца ў вадзе: пры 20 °С у адным аб’ёме вады раствараецца каля 700 аб’ёмаў аміяку (параўнаем: О2 — 0,03, SO2 — 40, НСl — 400 аб’ёмаў). Тэмпература кіпення аміяку даволі высокая і складае –33 °С. Пры невялікім ціску гэты газ лёгка звадкоўваецца. Тэмпература плаўлення — –78 °С, ніжэй за яе аміяк існуе ў выглядзе бясколерных крышталёў. Высокая тэмпература кіпення і растваральнасць у вадзе абумоўлены наяўнасцю значнага міжмалекулярнага ўзаемадзеяння, гэта значыць утварэннем вадародных сувязей як паміж самімі малекуламі аміяку (у цвёрдым і вадкім станах), так і паміж малекуламі вады і аміяку (у водным растворы) (мал. 90).
Атрыманне аміяку. Аміяк з’яўляецца адным з ключавых прадуктаў хімічнай прамысловасці. Яго сусветная вытворчасць расце разам з глабальным попытам на ўгнаенні і ў цяперашні час перавышае 220 млн тон за год. У Рэспубліцы Беларусь яго вырабляе ААТ «Гродна Азот» — больш за 1 млн тон за год.
У прамысловасці аміяк сінтэзуюць з азоту і вадароду. Рэакцыя экзатэрмічная і абарачальная, каталізатарам служыць жалеза, аптымальная тэмпература сінтэзу — 420–450 °С, ціск — 30–100 МПа:
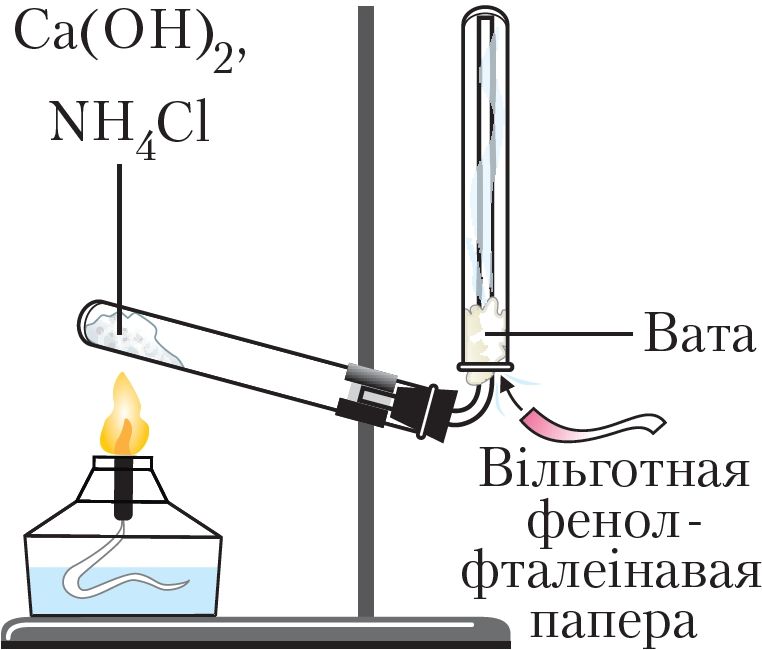
Для атрымання аміяку ў лабараторыі награваюць сумесь двух цвёрдых рэчываў — хларыду амонію NH4Cl і гідраксіду кальцыю Са(ОН)2 (мал. 91):
Хімічныя ўласцівасці. Для аміяку характэрны рэакцыі, якія праходзяць як без змены ступені акіслення азоту, так і акісляльна-аднаўленчыя.
У першым выпадку асноўную ролю адыгрывае непадзеленая электронная пара атама азоту. За кошт яе ўтвараюцца новыя кавалентныя сувязі па донарна-акцэптарным механізме. З іншага боку, наяўнасць атама азоту ў найніжэйшай ступені акіслення –3 абумоўлівае рэакцыі толькі з павышэннем ступені акіслення. Гэта азначае, што аміяк праяўляе ўласцівасці адноўніку.
I. Рэакцыі без змянення ступені акіслення працякаюць, калі аміяк узаемадзейнічае з вадой і кіслотамі. Пры гэтым аміяк праяўляе асноўныя ўласцівасці.
Растварэнне аміяку ў вадзе прыводзіць да ўтварэння гідрату аміяку NH3 ∙ H2O — слабой асновы (мал. 92).
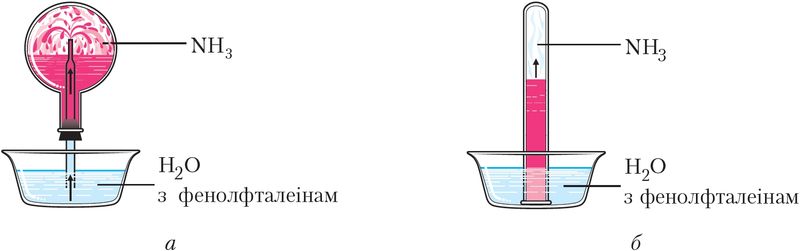
Водныя растворы аміяку маюць шчолачнае асяроддзе (рН > 7) і афарбоўваюцца фенолфталеінам у малінавы колер.
Узаемадзеянне аміяку з кіслотамі:
II. Рэакцыі са змяненнем ступені акіслення атама азоту. Гэта рэакцыі аміяку як адноўніку. Аднаўленчыя ўласцівасці аміяк праяўляе ў рэакцыях з кіслародам. Састаў прадуктаў залежыць ад умоў правядзення рэакцыі. У чыстым кіслародзе і на паветры ён згарае пры награванні (у сумесях — выбухае) з утварэннем азоту і вады, а ў прысутнасці каталізатараў плаціны, аксідаў жалеза(III) і хрому(III) утвараюцца аксід азоту(II) і вада:
Рэакцыя каталітычнага акіслення аміяку важная як этап яго перапрацоўкі ў азотную кіслату.