§ 37. Аміяк
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 37. Аміяк |
| Напечатано:: | Гость |
| Дата: | Понедельник, 11 Август 2025, 11:02 |
Вадароднае злучэнне азоту аміяк — рэчыва малекулярнай будовы. Яго структурная формула ![]() . У малекуле аміяку, як паказана ў § 13, тры адзінарныя кавалентныя палярныя сувязі, утвораныя па абменным механізме. Электронная шчыльнасць зрушана да атама азоту, у якога ёсць непадзеленая пара s-электронаў. Таму малекула аміяку палярная і мае канфігурацыю трыганальнай піраміды (мал. 89).
. У малекуле аміяку, як паказана ў § 13, тры адзінарныя кавалентныя палярныя сувязі, утвораныя па абменным механізме. Электронная шчыльнасць зрушана да атама азоту, у якога ёсць непадзеленая пара s-электронаў. Таму малекула аміяку палярная і мае канфігурацыю трыганальнай піраміды (мал. 89).
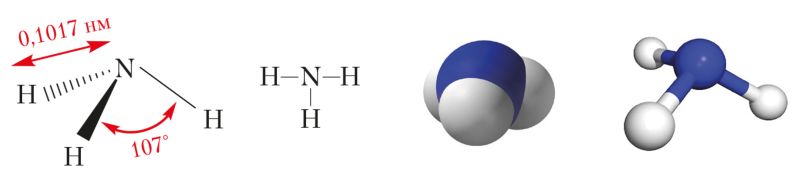
Узаемнае адштурхоўванне атамаў вадароду прыводзіць да павелічэння валентнасці вугла паміж напрамкамі кавалентных сувязей N—H ад 90° да 107°.
Будова малекулы аміяку. Форма піраміды ў малекуле аміяку і валентны вугал 107° пры яе вяршыні тлумачацца ўтварэннем сувязей паміж гібрыднымі арбіталямі атама азоту і s-арбіталямі атама вадароду.
Згодна з канцэпцыяй гібрыдызацыі, ва ўтварэнні кавалентных сувязей удзельнічаюць не зыходныя валентныя тры 2p-арбіталі знешняга электроннага ўзроўню атама азоту, а тры з чатырох sp3-гібрыдных арбіталей, схема ўтварэння якіх паказана на малюнку 89.1 (а–г).
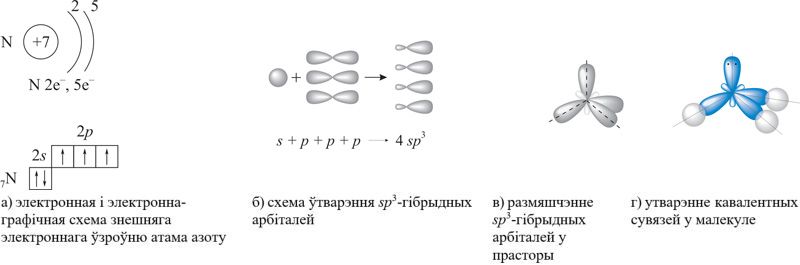
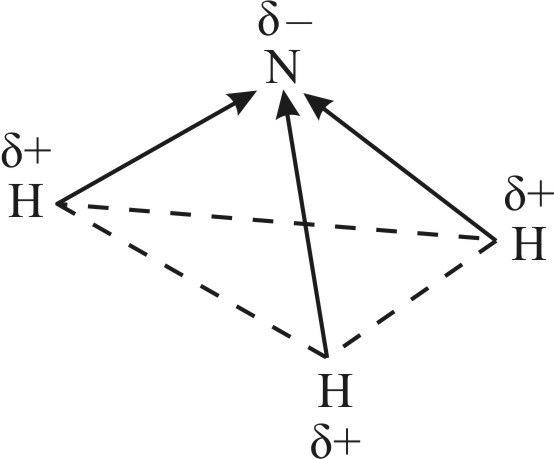
Непадзеленая электронная пара чацвёртай гібрыднай арбіталі валодае нязначнай адштурхоўвальнай сілай, што тлумачыць памяншэнне валентнасці вугла H—N—H з 109,5° да 107. Размяшчэнне трох кавалентных палярных сувязей пад вуглом прыводзіць да асіметрычнага размеркавання электроннай шчыльнасці, гэта значыць да палярнасці малекулы:
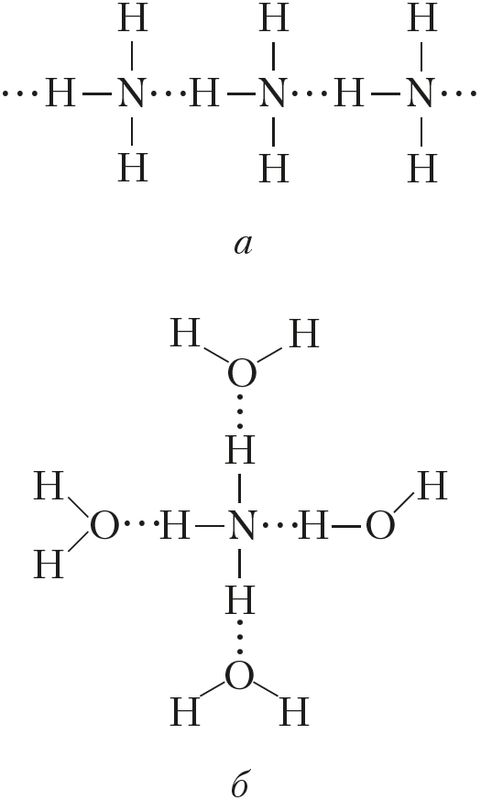
Фізічныя ўласцівасці. Аміяк — бясколерны газ (н. у.) з характэрным рэзкім пахам (пах нашатырнага спірту). Ён добра раствараецца ў вадзе: пры 20 °С у адным аб’ёме вады раствараецца каля 700 аб’ёмаў аміяку (параўнаем: О2 — 0,03, SO2 — 40, НСl — 400 аб’ёмаў). Тэмпература кіпення аміяку даволі высокая і складае –33 °С. Пры невялікім ціску гэты газ лёгка звадкоўваецца. Тэмпература плаўлення — –78 °С, ніжэй за яе аміяк існуе ў выглядзе бясколерных крышталёў. Высокая тэмпература кіпення і растваральнасць у вадзе абумоўлены наяўнасцю значнага міжмалекулярнага ўзаемадзеяння, гэта значыць утварэннем вадародных сувязей як паміж самімі малекуламі аміяку (у цвёрдым і вадкім станах), так і паміж малекуламі вады і аміяку (у водным растворы) (мал. 90).
Атрыманне аміяку. Аміяк з’яўляецца адным з ключавых прадуктаў хімічнай прамысловасці. Яго сусветная вытворчасць расце разам з глабальным попытам на ўгнаенні і ў цяперашні час перавышае 220 млн тон за год. У Рэспубліцы Беларусь яго вырабляе ААТ «Гродна Азот» — больш за 1 млн тон за год.
У прамысловасці аміяк сінтэзуюць з азоту і вадароду. Рэакцыя экзатэрмічная і абарачальная, каталізатарам служыць жалеза, аптымальная тэмпература сінтэзу — 420–450 °С, ціск — 30–100 МПа:
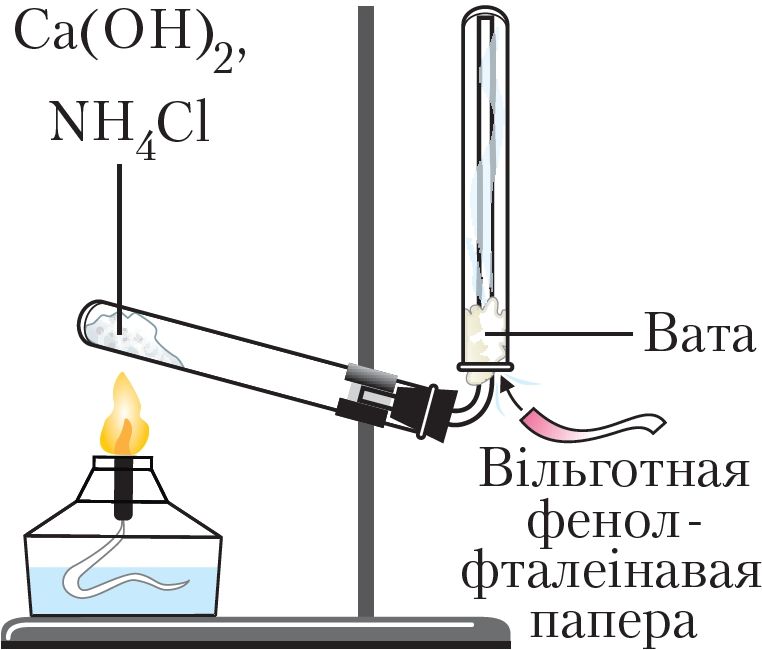
Для атрымання аміяку ў лабараторыі награваюць сумесь двух цвёрдых рэчываў — хларыду амонію NH4Cl і гідраксіду кальцыю Са(ОН)2 (мал. 91):
Хімічныя ўласцівасці. Для аміяку характэрны рэакцыі, якія праходзяць як без змены ступені акіслення азоту, так і акісляльна-аднаўленчыя.
У першым выпадку асноўную ролю адыгрывае непадзеленая электронная пара атама азоту. За кошт яе ўтвараюцца новыя кавалентныя сувязі па донарна-акцэптарным механізме. З іншага боку, наяўнасць атама азоту ў найніжэйшай ступені акіслення –3 абумоўлівае рэакцыі толькі з павышэннем ступені акіслення. Гэта азначае, што аміяк праяўляе ўласцівасці адноўніку.
I. Рэакцыі без змянення ступені акіслення працякаюць, калі аміяк узаемадзейнічае з вадой і кіслотамі. Пры гэтым аміяк праяўляе асноўныя ўласцівасці.
Растварэнне аміяку ў вадзе прыводзіць да ўтварэння гідрату аміяку NH3 ∙ H2O — слабой асновы (мал. 92).
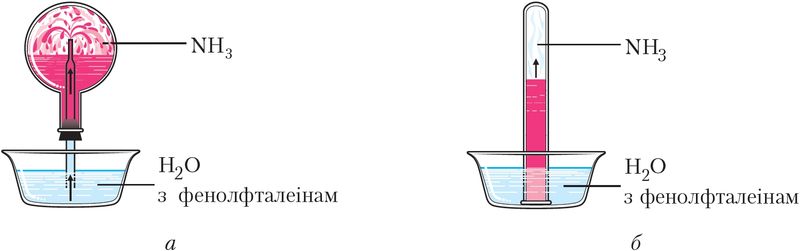
Водныя растворы аміяку маюць шчолачнае асяроддзе (рН > 7) і афарбоўваюцца фенолфталеінам у малінавы колер.
Узаемадзеянне аміяку з кіслотамі:
II. Рэакцыі са змяненнем ступені акіслення атама азоту. Гэта рэакцыі аміяку як адноўніку. Аднаўленчыя ўласцівасці аміяк праяўляе ў рэакцыях з кіслародам. Састаў прадуктаў залежыць ад умоў правядзення рэакцыі. У чыстым кіслародзе і на паветры ён згарае пры награванні (у сумесях — выбухае) з утварэннем азоту і вады, а ў прысутнасці каталізатараў плаціны, аксідаў жалеза(III) і хрому(III) утвараюцца аксід азоту(II) і вада:
Рэакцыя каталітычнага акіслення аміяку важная як этап яго перапрацоўкі ў азотную кіслату.
Солі амонію
Рэакцыі аміяку з кіслотамі дазваляюць атрымаць разнастайныя солі амонію.
Солі амонію ўяўляюць сабой цвёрдыя крышталічныя рэчывы, добра растваральныя ў вадзе. Іх растворы з’яўляюцца моцнымі электралітамі, што дысацыіруюць з утварэннем катыёна амонію і аніёна кіслотнага астатку:
Найважнейшая асаблівасць солей амонію — узаемадзеянне са шчолачамі з вылучэннем аміяку:
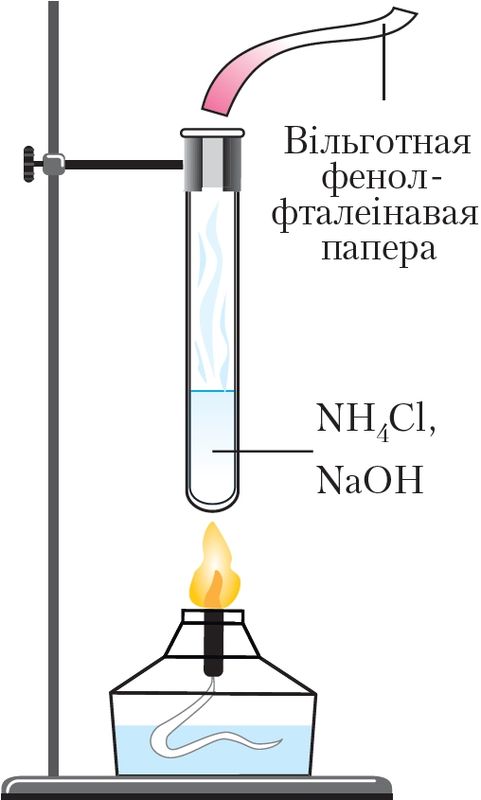
Узаемадзеянне солей амонію са шчолачамі пры награванні выкарыстоўваюць для выяўлення іонаў амонію (якасная рэакцыя на іон ). Для гэтага да награванай сумесі падносяць вільготную індыкатарную паперку. У прысутнасці аміяку фенолфталеінавая папера становіцца малінавай, лакмусавая — сіняй (мал. 93, рис. 93, Дадатак 3).
Другой асаблівасцю солей амонію з’яўляецца іх тэрмічная няўстойлівасць.
Раскладанне кожнай з солей амонію спецыфічнае. Так, шырока ўжываныя ў якасці разрыхляльнікаў для цеста карбанат і гідракарбанат амонію (харчовая дабаўка Е503) раскладаюцца ўжо пры невялікім награванні з утварэннем аміяку, вуглякіслага газу і вады:
(NH4)2СO3 2NH3 + СО2 + Н2О;
NH4НСO3 NH3 + СО2 + Н2О.
Хларыд амонію раскладаецца на аміяк і хлоравадарод:
NH4Cl NH3 + HCl.
Прымяненне аміяку і солей амонію. Асноўная частка вырабленага аміяку ідзе на вытворчасць угнаенняў (аміячная салетра NH4NO3, сульфат амонію (NH4)2SO4, мачавіна (NH2)2СO і інш.) і азотнай кіслаты. Аміяк запатрабаваны ў вытворчасці соды, фарбавальнікаў, палімераў. Яго выкарыстоўваюць у жывёлагадоўлі для павышэння ўтрымання азоту ў кармах. Аміячную ваду (18–25%-ны водны раствор) ужываюць як вадкае ўгнаенне. Нашатырны спірт (водны раствор аміяку з масавай доляй 3–10 %) выкарыстоўваюць у медыцыне. У побыце нашатырны спірт ужываюць для вывядзення плям з адзежы, пры чыстцы посуду, сантэхнікі, ювелірных упрыгажэнняў, для мыцця шкла і крышталю.
Не варта блытаць нашатырны спірт (NH3 ∙ H2O) з нашатыром — соллю і мінералам складу NH4Cl.
Нашатыр ужываюць у якасці ўгнаення на нейтральных і шчолачных глебах, выкарыстоўваюць як флюс для выдалення аксіднай плёнкі пры пайцы металаў, у гальванічных элементах як кампанент электраліту (мал. 94), карбанат і гідракарбанат амонію выкарыстоўваюць у якасці разрыхляльнікаў для цеста пры выпечцы.

Аміяк NH3 праяўляе ўласцівасці адноўніку ў рэакцыях з кіслародам і іншымі акісляльнікамі. Водны раствор аміяку з’яўляецца слабай асновай.
Аміяк атрымліваюць у прамысловасці сінтэзам з вадароду і азоту, у лабараторыі — з хларыду амонію і гашанай вапны.
Найважнейшыя галіны выкарыстання аміяку — вытворчасць угнаенняў і азотнай кіслаты.
Солі амонію выяўляюць па вылучэнні аміяку пры награванні іх са шчолаччу.
Пытанні, заданні, задачы
1. З прыведзенага рада выпішыце формулы:
- а) вадародных злучэнняў элементаў VА-групы;
- б) нелятучых вадародных злучэнняў: NH3, NаH, СН4, LiH, РH3, AsH3, СаН2.
2. Пакажыце агрэгатны стан аміяку пры ціску 101,325 кПа ў наступных тэмпературных інтэрвалах:
- а) ад –33 °С да –80 °С;
- б) ад –5 °С да +80 °С;
- в) ад –50 °С да –70 °С;
- г) ад –25 °С да +25 °С.
3. Вызначце адносную шчыльнасць аміяку па вадародзе і паветры. У адносінах да якога з названых газаў аміяк лягчэйшы?
4. Намалюйце схемы ўтварэння вадародных сувязей:
- а) у вадкім аміяку;
- б) паміж малекуламі вады;
- в) у растворы аміяку ў вадзе.
Чаму аміяк нельга збіраць метадам выцяснення вады?
5. Пералічыце ўмовы сінтэзу аміяку ў прамысловасці. Запішыце ўраўненне гэтай рэакцыі. Чаму сінтэз вядуць пры высокім ціску?
6. Разлічыце аб’ём (н. у.) аміяку, які вылучыўся ў рэакцыі хларыду амонію масай 5,35 г з дастатковай колькасцю гідраксіду кальцыю.
7. Вызначце хімічную формулу злучэння, у якім масавыя долі азоту, вадароду, серы і кіслароду адпаведна роўныя 12,17 %, 4,35 %, 27,83 %, 55,65 %.
8. Складзіце ўраўненні рэакцый паводле схемы:
- а)
- б)
.
9. У чатыры прабіркі з растворамі солей дадалі раствор гідраксіду натрыю. У першай прабірцы выпаў белы асадак, у трэцяй — блакітны. У другой і чацвёртай бачных змен не назіралі, таму іх падагрэлі і да адтулін паднеслі вільготную фенолфталеінавую паперу. Пры гэтым папера стала малінавай над чацвёртай прабіркай. Назавіце змесціва кожнай прабіркі, калі для вызначэння былі прапанаваны солі:
- а) нітрат натрыю, нітрат амонію, нітрат медзі(II), нітрат магнію;
- б) хларыд амонію, хларыд калію, сульфат медзі(II), хларыд кальцыю.
Напішыце ўраўненні адпаведных рэакцый.
10. Малярная маса газавай сумесі, якая складаецца з аміяку і вадароду, роўная 14 г/моль. Вызначце аб’ёмную долю аміяку ў сумесі.
*Самакантроль
1. Для аміяку справядлівыя сцвярджэнні:
- а) газ без паху;
- б) добра раствараецца ў вадзе;
- в) лягчэйшы за паветра;
- г) складаецца з палярных малекул.
2. Азот праяўляе ступень акіслення −3 у злучэннях:
- а) N2O3;
- б) NH3;
- в) N2;
- г) NH4Cl.
3. Аміяк утвараецца ў рэакцыях, схемы якіх:
- а) NH3 + O2 →;
- б) N2 + H2 →;
- в) NH4Cl + NaOH →;
- г) NH4Cl + АgNO3 →.
4. Ураўненне якаснай рэакцыі на іон амонію:
- а) Ag+ + Cl– = AgCl↓;
- б) NH3 + H+ =
;
- в)
+ OH–
NH3↑ + H2O;
- г) Ag+ + I– = AgI↓.
5. Як аснова аміяк рэагуе з:
- а) O2;
- б) HCl;
- в) H3РO4;
- г) Сl2.