§ 33. Вадародныя злучэнні кіслароду і серы
Вада
Вада — другое па распаўсюджанасці на Зямлі хімічнае злучэнне. Запасы вады на Зямлі ацэньваюцца ў 1,4 млрд км3. Яна складае ад 50 да 99 % масы раслін, жывёл, чалавека.
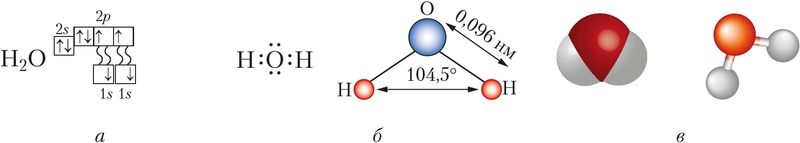
Будова малекулы. Малекула вады мае вуглавую будову, якую вызначаюць чатыры электронныя арбіталі знешняга электроннага слоя атама кіслароду: дзве з іх утвараюць кавалентныя палярныя сувязі з атамамі вадароду, іншыя дзве ўтрымліваюць непадзеленыя электронныя пары (мал. 77). Як вам вядома, вугал паміж напрамкамі сувязей Н—О ў малекуле вадзяной пары складае 104,5° і малекулы ўяўляюць сабой дыполі (§ 14, мал. 33).
Асаблівасці фізічных уласцівасцей. Вада не мае колеру, смаку, паху, валодае высокай цеплаёмістасцю. Вада існуе ў прыродзе ў трох агрэгатных станах (вадкім, цвёрдым, газападобным). Яе тэмпература плаўлення — 0 °С, кіпення — 100 °С пры p = 101,325 кПа. Паміж малекуламі вады ў вадкім і цвёрдым станах існуюць трывалыя вадародныя сувязі (25 кДж/моль) (§ 17, мал. 43).
Вада, з’яўляючыся вельмі слабым электралітам, практычна не праводзіць электрычны ток. На іоны распадаюцца прыблізна дзве малекулы з мільярда (пры 25 °С): .
Хімічныя ўласцівасці вады. Вада ўступае ў рэакцыі з многімі рэчывамі як пры пакаёвай тэмпературы, так і пры награванні: металамі, асноўнымі і кіслотнымі аксідамі, арганічнымі рэчывамі. Разгледзім некаторыя асаблівасці гэтых узаемадзеянняў.
1. Характар узаемадзеяння вады з металамі залежыць ад актыўнасці металу. Так, шчолачныя і шчолачназямельныя (Са, Ва, Sr, Ra) металы рэагуюць пры пакаёвай тэмпературы з утварэннем вадароду і шчолачы:
Большасць металаў, размешчаных у радзе актыўнасці паміж алюмініем і вадародам, уступаюць у рэакцыю з парамі вады з утварэннем вадароду і аксідаў металаў. Металы, размешчаныя пасля вадароду, ні пры якіх умовах з вадой не рэагуюць. Больш дэталёва вы вывучыце рэакцыі ўзаемадзеяння металаў з вадой у раздзеле 7.
2. Узаемадзеянне вады з кіслотнымі аксідамі прыводзіць да ўтварэння кіслот:
SO3 + H2O = H2SO4.
3. Асноўныя аксіды шчолачных і шчолачназямельных металаў у рэакцыях з вадой утвараюць шчолачы:
СаО + Н2О = Са(ОН)2↓.
4. З арганічнымі рэчывамі вада ўступае ў рэакцыі гідратацыі (ненасычаных злучэнняў) і гідролізу (складаных эфіраў, вугляводаў, бялкоў). Напрыклад:
Гідроліз бялкоў, ды- і поліцукрыдаў, тлушчаў — гэта першы этап засваення (стрававання) ежы.
5. Вада ўступае ў рэакцыі з галагенамі. Фтор акісляе кісларод у малекуле вады:
2H2O + 2F2 = 4HF + O2↑.
Рэакцыі з хлорам і бромам працякаюць абарачальна з утварэннем дзвюх кіслот, у адной з якіх ступень акіслення атама галагену павышаная, а ў другой паніжаная:
6. З іоннымі гідрыдамі металаў вада выступае ў якасці акісляльніку:
NaH + H2O = NaOH + H2↑.
7. Солі слабых кіслот і солі неактыўных металаў, а таксама солі амонію ў водным асяроддзі падвяргаюцца гідролізу (см. § 27.1.):
СН3СОО– + НОН СН3СООН + ОН–;
.