§ 33. Вадародныя злучэнні кіслароду і серы
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 33. Вадародныя злучэнні кіслароду і серы |
| Напечатано:: | Гость |
| Дата: | Пятница, 27 Июнь 2025, 08:27 |
Найважнейшымі вадароднымі злучэннямі кіслароду і серы з’яўляюцца вада H2O і серавадарод H2S. Акрамя таго, існуюць і іншыя бінарныя злучэнні кіслароду і серы, напрыклад пераксіду вадароду Н2О2.
Вада
Вада — другое па распаўсюджанасці на Зямлі хімічнае злучэнне. Запасы вады на Зямлі ацэньваюцца ў 1,4 млрд км3. Яна складае ад 50 да 99 % масы раслін, жывёл, чалавека.
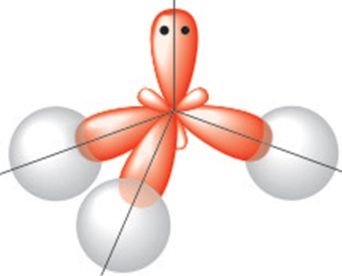
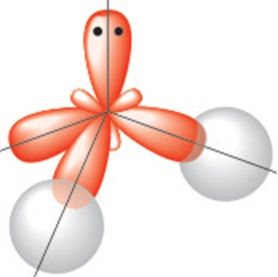
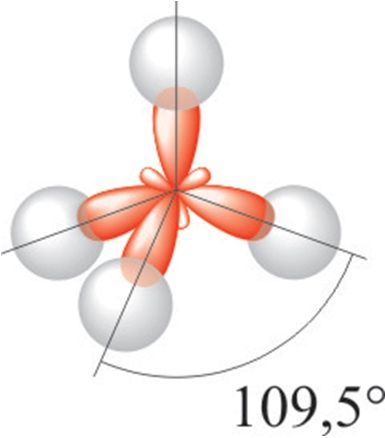
Будова малекулы. Малекула вады мае вуглавую будову, якую вызначаюць чатыры электронныя арбіталі знешняга электроннага слоя атама кіслароду: дзве з іх утвараюць кавалентныя палярныя сувязі з атамамі вадароду, іншыя дзве ўтрымліваюць непадзеленыя электронныя пары (мал. 77). Як вам вядома, вугал паміж напрамкамі сувязей Н—О ў малекуле вадзяной пары складае 104,5° і малекулы ўяўляюць сабой дыполі (§ 14, мал. 33).
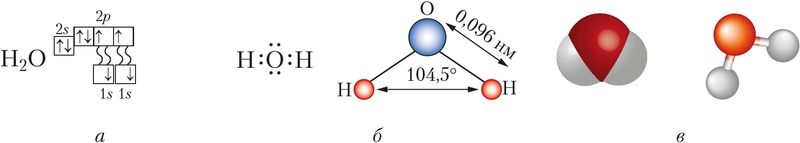
Асаблівасці фізічных уласцівасцей. Вада не мае колеру, смаку, паху, валодае высокай цеплаёмістасцю. Вада існуе ў прыродзе ў трох агрэгатных станах (вадкім, цвёрдым, газападобным). Яе тэмпература плаўлення — 0 °С, кіпення — 100 °С пры p = 101,325 кПа. Паміж малекуламі вады ў вадкім і цвёрдым станах існуюць трывалыя вадародныя сувязі (25 кДж/моль) (§ 17, мал. 43).
Вада, з’яўляючыся вельмі слабым электралітам, практычна не праводзіць электрычны ток. На іоны распадаюцца прыблізна дзве малекулы з мільярда (пры 25 °С): .
Хімічныя ўласцівасці вады. Вада ўступае ў рэакцыі з многімі рэчывамі як пры пакаёвай тэмпературы, так і пры награванні: металамі, асноўнымі і кіслотнымі аксідамі, арганічнымі рэчывамі. Разгледзім некаторыя асаблівасці гэтых узаемадзеянняў.
1. Характар узаемадзеяння вады з металамі залежыць ад актыўнасці металу. Так, шчолачныя і шчолачназямельныя (Са, Ва, Sr, Ra) металы рэагуюць пры пакаёвай тэмпературы з утварэннем вадароду і шчолачы:
Большасць металаў, размешчаных у радзе актыўнасці паміж алюмініем і вадародам, уступаюць у рэакцыю з парамі вады з утварэннем вадароду і аксідаў металаў. Металы, размешчаныя пасля вадароду, ні пры якіх умовах з вадой не рэагуюць. Больш дэталёва вы вывучыце рэакцыі ўзаемадзеяння металаў з вадой у раздзеле 7.
2. Узаемадзеянне вады з кіслотнымі аксідамі прыводзіць да ўтварэння кіслот:
SO3 + H2O = H2SO4.
3. Асноўныя аксіды шчолачных і шчолачназямельных металаў у рэакцыях з вадой утвараюць шчолачы:
СаО + Н2О = Са(ОН)2↓.
4. З арганічнымі рэчывамі вада ўступае ў рэакцыі гідратацыі (ненасычаных злучэнняў) і гідролізу (складаных эфіраў, вугляводаў, бялкоў). Напрыклад:
Гідроліз бялкоў, ды- і поліцукрыдаў, тлушчаў — гэта першы этап засваення (стрававання) ежы.
5. Вада ўступае ў рэакцыі з галагенамі. Фтор акісляе кісларод у малекуле вады:
2H2O + 2F2 = 4HF + O2↑.
Рэакцыі з хлорам і бромам працякаюць абарачальна з утварэннем дзвюх кіслот, у адной з якіх ступень акіслення атама галагену павышаная, а ў другой паніжаная:
6. З іоннымі гідрыдамі металаў вада выступае ў якасці акісляльніку:
NaH + H2O = NaOH + H2↑.
7. Солі слабых кіслот і солі неактыўных металаў, а таксама солі амонію ў водным асяроддзі падвяргаюцца гідролізу (см. § 27.1.):
СН3СОО– + НОН СН3СООН + ОН–;
.
Серавадарод
Будова малекулы. Будову малекулы серавадароду можна растлумачыць перакрыццём атамных 3р-арбіталей серы і 1s-арбіталі атамаў вадароду (§ 14, мал. 32). Пры гэтым адбываецца адштурхоўванне абласцей павышанай электроннай шчыльнасці, якія ўзніклі пры ўтварэнні σ-сувязі. У выніку гэтага валентны вугал крыху павялічваецца — узрастае ад 90°
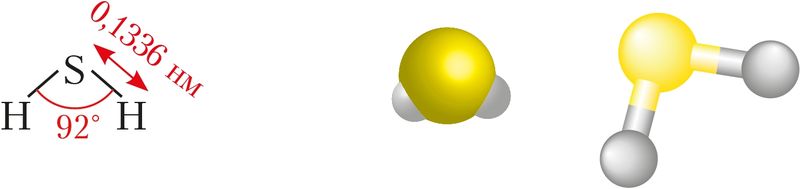
Фізічныя ўласцівасці. Серавадарод — бясколерны газ з пахам тухлых яек. Ён цяжэйшы за паветра і мае больш нізкія тэмпературы кіпення (–60 °С) і плаўлення (–86 °С) у параўнанні з вадой. У адным аб’ёме вады раствараюцца тры аб’ёмы серавадароду. Пры гэтым утвараецца раствор вельмі слабай кіслаты — серавадароднай:
З ураўненняў дысацыяцыі вынікае, што кіслаце адпавядаюць два рады солей — кіслыя (гідрасульфіды, напрыклад NaHS, Ca(HS)2) і сярэднія (сульфіды, напрыклад Na2S, CaS).
Уплыў на арганізм чалавека. Серавадарод вельмі атрутны. Пры яго ўдыханні хутка адбываецца параліч дыхальных нерваў, чалавек перастае адчуваць пахі, што тоіць у сабе смяротную пагрозу. Трапляючы ў кроў, серавадарод разбурае гемаглабін і ўтварае сульфід жалеза чорнага колеру — «кроў чарнее». Працаваць з серавадародам у лабараторыях можна толькі ў выцяжной шафе.
У прыродзе серавадарод утвараецца ў невялікіх колькасцях пры гніенні бялкоў, утрымліваецца ў вулканічных газах, у атмасферы прамысловых рэгіёнаў. Серавадарод цяжэйшы за паветра, таму збіраецца ў каналізацыйных калодзежах, ямах. Налічваецца нямала выпадкаў, калі пацярпелымі станавіліся рабочыя, якія абслугоўваюць трубаправоды.
У арганізме серавадарод утвараецца з амінакіслаты — цыстэіну. Эндагенны (які выпрацаваўся ўнутры арганізма) серавадарод з’яўляецца спазмалітыкам — расслабляе гладкія мышцы, а таксама лічыцца адным з важных фактараў, якія абараняюць арганізм ад сардэчна-сасудзiстых захворванняў.
Прымяненне серавадароду і сульфідаў. Серавадарод знаходзіць абмежаванае прымяненне. Серавадародную ваду і газападобны серавадарод выкарыстоўваюць у аналітычнай хіміі для вызначэння (асаджэння) катыёнаў металаў, сульфіды якіх маларастваральныя і нерастваральныя.
Сульфіды многіх металаў ярка афарбаваныя: HgS, Ag2S, PbS, CuS — чорныя, Sb2S3 — аранжавы, CdS — жоўты, MnS — ружовы, ZnS — белы. Сульфіды шчолачных і шчолачназямельных металаў бясколерныя.
Адной з асноўных прычын пацямнення карцін старых майстроў з’яўляецца выкарыстанне імі свінцовых бялілаў. Узаемадзейнічаючы нават са следавымі колькасцямі серавадароду ў паветры, бялілы за некалькі стагоддзяў ператвараюцца ў чорны сульфід свінцу(II) PbS. Пры рэстаўрацыі яго акісляюць пераксідам вадароду: PbS(чорны) + 4H2O2 = PbSO4(белы) + 4H2O.
У тэхніцы сульфіды ўжываюць як крыніцы нецеплавога выпраменьвання — люмінафоры (CdS, ZnS), змазачныя матэрыялы (МоS2), паўправаднікі (CuS, CdS, PbS і іншыя).
У медыцыне выкарыстоўваюць штучныя і прыродныя серавадародныя ванны, серавадародную мінеральную ваду.
У хімічнай прамысловасці серавадарод служыць сыравінай для атрымання серы, сернай кіслаты, сульфідаў і серазмяшчальных арганічных злучэнняў. Напрыклад, меркаптаны як адны з самых смуродных рэчываў служаць дадаткам да прыроднага газу для выяўлення яго ўцечкі ў трубаправодах.
*Хімічныя ўласцівасці серавадароду
1. Для серавадароду найбольш характэрныя аднаўленчыя ўласцівасці за кошт атамаў серы ў ступені акіслення –2. Прыкладам можа служыць узаемадзеянне серавадароду з кіслародам і аксідам серы(IV).
2. Пры ўзаемадзеянні з кіслародам (гарэнне) у лішку кіслароду ўтвараецца аксід серы(IV), а пры яго недахопе — сера:
;
.
3. Пры ўзаемадзеянні з аксідам серы(IV) утвараецца свабодная сера:
.
Гэтыя працэсы ляжаць у аснове прамысловага атрымання серы пры нафтаперапрацоўцы, а таксама з адыходных газаў металургічных і коксавых печаў.
Серавадародная кіслата і яе солі
Слабая двухасноўная серавадародная кіслата выяўляе ўсе агульныя ўласцівасці кіслот: рэагуе з металамі, асноўнымі аксідамі, асновамі і солямі. Уступаючы ў рэакцыі абмену, яна ўтварае два рады солей — сульфіды і гідрасульфіды:
2NaOH + H2S = Na2S + 2H2O (cульфід натрыю, сярэдняя соль);
NaOH + H2S = NaHS + H2O (гідрасульфід натрыю, кіслая соль).
Сульфіды і гідрасульфіды шчолачных і шчолачназямельных металаў — NaHS, KНS, Ba(HS)2 — добра раствараюцца ў вадзе. Сульфіды іншых металаў у пераважнай большасці нерастваральныя. Сульфіды свінцу, медзі, ртуці, серабра і некаторых іншых металаў не раствараюцца нават у салянай і сернай кіслотах.
З гэтай прычыны сульфіды можна асаджваць серавадародам з раствораў солей:
CuSO4 + H2S = CuS↓ + H2SO4.
CuSO4 + H2S = CuS↓ + H2SO4.
Сульфід-іоны лёгка выявіць, выкарыстоўваючы якасную рэакцыю на серавадародную кіслату і яе солі. Рэактывам на серавадародную кіслату і яе растваральныя ў вадзе солі могуць быць, напрыклад, сульфат медзі(II) або нітрат свінцу(II), пры ўзаемадзеянні з якімі з раствору выпадае чорны асадак сульфіду медзі(II) або свінцу(II):
Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3;
Pb2+ + S2– = PbS↓.
Сульфіды большасці металаў, прычым нават нерастваральныя ў вадзе, выяўляюць з іх узаемадзеяння з кіслатой, у выніку якога вылучаецца серавадарод са спецыфічным непрыемным пахам.
Малекулы вады і серавадароду маюць вуглавую будову.
Вада рэагуе пры пакаёвай тэмпературы з актыўнымі металамі, кіслотнымі і асноўнымі аксідамі.
Водны раствор серавадароду — слабая кіслата.
Пытанні, заданні, задачы
1. Назавіце хімічныя формулы вадародных злучэнняў кіслароду і серы.
2. Пералічыце фізічныя ўласцівасці:
- а) вады;
- б) серавадароду.
Якое фізіялагічнае ўздзеянне серавадароду на арганізм?
3. Апішыце прасторавую будову:
- а) малекулы вады;
- б) малекулы серавадароду.
Параўнайце валентныя вуглы ў гэтых малекулах.
4. Назавіце рэчывы і пакажыце ступені акіслення атамаў:
Н2S, H2O2, ZnS, FeS, Al2S3, NaHS.
5. Складзіце ўраўненні рэакцый:
- а) Na + H2O →; Ba + H2O →; P2O5 + H2O →; SO2 + H2O →;
- б) H2S + FeCl2 →; H2S + NaOH →; H2S + Ba(OH)2 →; H2S + CuSO4 →.
На падставе складзеных ураўненняў рэакцый зрабіце выснову пра хімічныя ўласцівасці вадароднага злучэння.
6. Складзіце схему ўтварэння вадародных сувязей:
- а) паміж малекуламі вады;
- б) малекуламі вады і метанолу.
Растлумачце, чаму не раствараюцца ў вадзе бензол, гексан.
7. Выкарыстоўваючы звесткі малюнка 44 з § 17, растлумачце:
- а) змяненне тэмпературы кіпення рэчываў у радзе H2S — H2Sе — H2Те;
- б) анамальна высокае значэнне тэмпературы кіпення вады.
8. Разлічыце масавую долю серавадароду ў серавадароднай вадзе, атрыманай пры растварэнні газу (н. у.) аб’ёмам 3 дм3 у вадзе аб’ёмам 1 дм3 (4 °С).
9. Праз раствор, які змяшчае гідраксід натрыю масай 20 г, прапусцілі серавадарод аб’ёмам 11,2 дм3 (н. у.). Вызначце малярную канцэнтрацыю солі ў канчатковым растворы, калі вядома, што аб’ём раствору роўны 2,5 дм3.
10. Cеравадарод аб’ёмам 1,12 дм3 (н. у.) прапусцілі праз раствор масай 125 г з масавай доляй сульфату медзі(II), роўнай 10 %. Разлічыце масавую долю солі ва ўтвораным растворы.
*Самакантроль
1. Да вадародных злучэнняў элементаў VIA-групы адносяцца:
- а) H2O;
- б) H2O2;
- в) H2S2;
- г) H2S.
2. Назавіце рэчыва, якое пры траплянні ў кроў разбурае гемаглабін:
- а) H2O;
- б) O2;
- в) С6H12О6 (глюкоза);
- г) H2S.
3. Пры пакаёвай тэмпературы рэагуюць:
- а) вада і калій;
- б) серавадародная кіслата і гідраксід натрыю;
- в) магній і вада;
- г) вада і аксід барыю.
4. Рэагуе з вадой з утварэннем гідраксіду:
- а) цынк;
- б) кальцый;
- в) жалеза;
- г) медзь.
5. Перакрыванню электронных арбіталей у малекуле вады адпавядае схема: