§ 31. Злучэнні галагенаў
Хлоравадародная кіслата
Хлоравадародная (саляная) кіслата HCl — буйнатанажны прадукт хімічнай прамысловасці. Яна з’яўляецца водным растворам хлоравадароду, які ўяўляе сабой бясколерны газ з рэзкім пахам. Растваральнасць HCl пры 20 °С складае каля 450 аб’ёмаў на 1 аб’ём вады.
Канцэнтраваная саляная кіслата, якая ўтрымлівае 36–38 % хлоравадароду і мае шчыльнасць 1,19 г/см3, дыміць на паветры, бо з яе вылучаецца газападобны хлоравадарод. Разбаўленыя растворы НСl не дымяць.
У прамысловасці саляную кіслату атрымліваюць растварэннем у вадзе хлоравадароду. Пры гэтым хлоравадарод сінтэзуюць з простых рэчываў:
H2 + Cl2 = 2HCl.
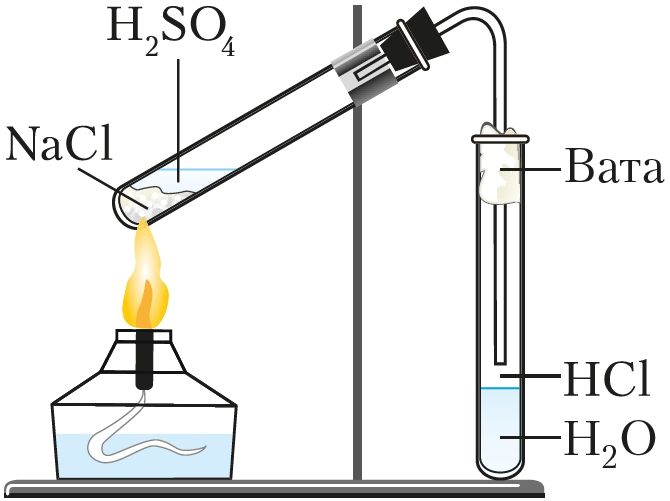
У лабараторных умовах хлоравадарод атрымліваюць уздзеяннем канцэнтраванай сернай кіслаты на хларыды (NaCl або KCl) пры награванні (мал. 71):
.
Хімічныя ўласцівасці. З’яўляючыся моцным электралітам, хлоравадародная кіслата дысацыіруе з утварэннем іонаў вадароду і хларыд-іонаў:
HCl → H+ + Cl–
і валодае ўсімі агульнымі ўласцівасцямі кіслот: дзейнічае на індыкатары і ўтварае солі (хларыды) пры ўзаемадзеянні з металамі (1), асноўнымі і амфатэрнымі аксідамі (2), гідраксідамі металаў (3), солямі (4):
| 1 | Fe + 2HCl = FeCl2 + H2↑ метал |
Fe0 + 2H+ = Fe2+ + H2↑ |
| 2 | МgO + 2HCl = MgCl2 + H2O аксід асноўны |
MgO + 2H+ = Mg2+ + H2O |
| ZnO + 2HCl = ZnCl2 + H2O аксід амфатэрны |
ZnO + 2H+ = Zn2+ + H2O | |
| 3 | КOH + HCl = КCl + H2O аснова (шчолач) |
H+ + OH– = H2O |
| Al(OH)3 + 3HCl = AlCl3 + 3H2O амфатэрны гідраксід |
3H+ + Al(OH)3 = Al3+ + 3H2O | |
| 4 | Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ соль |
2H+ + |
Да спецыфічных уласцівасцей салянай кіслаты варта аднесці рэакцыі, абумоўленыя наяўнасцю аніёна Сl–. Вылучым два найважнейшыя.
1. Рэакцыі акіслення хларыд-іонаў. Іон хлору ў складзе хлоравадароднай кіслаты мае найніжэйшую ступень акіслення –1 і здольны яе павышаць пры страце электронаў. Значыць, за кошт іонаў хлору кіслата з’яўляецца адноўнікам. Напрыклад, для атрымання хлору ў лабараторыі выкарыстоўваюць рэакцыю канцэнтраванай салянай кіслаты з моцнымі акісляльнікамі (МnO2, KМnO4, KClO3):
.
2. Рэакцыі звязвання аніёна Сl– з катыёнамі некаторых металаў, напрыклад свінцу Pb2+, серабра Ag+ у растворы. Гэта ілюструюць ураўненні рэакцый:
2HCl + Pb(NO3)2 = PbCl2↓ + 2HNO3;
Pb2+ + 2Cl– = PbCl2↓;
HCl + AgNO3 = AgCl↓ + HNO3;
Ag+ + Cl– = AgCl↓.
Дзеянне нітрату серабра(I) прыводзіць да ўтварэння белага тварожыстага асадку AgCl, што выкарыстоўваюць як тэст (якасная рэакцыя) на хларыд-іоны (Дадатак 3).