§ 31. Злучэнні галагенаў
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 31. Злучэнні галагенаў |
| Напечатано:: | Гость |
| Дата: | Среда, 13 Август 2025, 04:49 |
Да найважнейшых злучэнняў галагенаў адносяць галагенавадароды саставу НЭ (Э — элемент галаген) і іх водныя растворы — галагенавадародныя кіслоты, а таксама ўтвораныя імі солі. Атамы ў малекулах галагенавадародаў звязаны кавалентнай палярнай адзінарнай σ-сувяззю. На малюнку 70 паказана ўтварэнне хімічнай сувязі ў малекуле HCl.
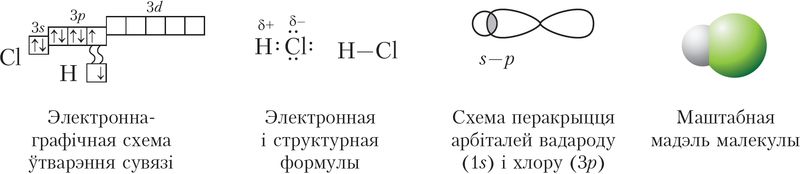
Хлоравадародная кіслата
Хлоравадародная (саляная) кіслата HCl — буйнатанажны прадукт хімічнай прамысловасці. Яна з’яўляецца водным растворам хлоравадароду, які ўяўляе сабой бясколерны газ з рэзкім пахам. Растваральнасць HCl пры 20 °С складае каля 450 аб’ёмаў на 1 аб’ём вады.
Канцэнтраваная саляная кіслата, якая ўтрымлівае 36–38 % хлоравадароду і мае шчыльнасць 1,19 г/см3, дыміць на паветры, бо з яе вылучаецца газападобны хлоравадарод. Разбаўленыя растворы НСl не дымяць.
У прамысловасці саляную кіслату атрымліваюць растварэннем у вадзе хлоравадароду. Пры гэтым хлоравадарод сінтэзуюць з простых рэчываў:
H2 + Cl2 = 2HCl.
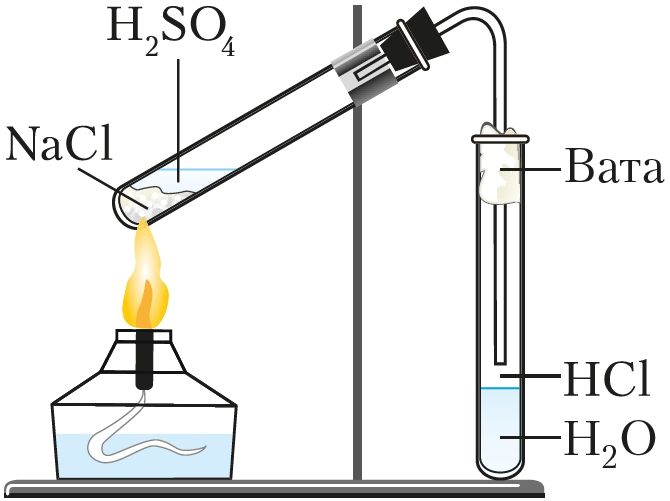
У лабараторных умовах хлоравадарод атрымліваюць уздзеяннем канцэнтраванай сернай кіслаты на хларыды (NaCl або KCl) пры награванні (мал. 71):
.
Хімічныя ўласцівасці. З’яўляючыся моцным электралітам, хлоравадародная кіслата дысацыіруе з утварэннем іонаў вадароду і хларыд-іонаў:
HCl → H+ + Cl–
і валодае ўсімі агульнымі ўласцівасцямі кіслот: дзейнічае на індыкатары і ўтварае солі (хларыды) пры ўзаемадзеянні з металамі (1), асноўнымі і амфатэрнымі аксідамі (2), гідраксідамі металаў (3), солямі (4):
| 1 | Fe + 2HCl = FeCl2 + H2↑ метал |
Fe0 + 2H+ = Fe2+ + H2↑ |
| 2 | МgO + 2HCl = MgCl2 + H2O аксід асноўны |
MgO + 2H+ = Mg2+ + H2O |
| ZnO + 2HCl = ZnCl2 + H2O аксід амфатэрны |
ZnO + 2H+ = Zn2+ + H2O | |
| 3 | КOH + HCl = КCl + H2O аснова (шчолач) |
H+ + OH– = H2O |
| Al(OH)3 + 3HCl = AlCl3 + 3H2O амфатэрны гідраксід |
3H+ + Al(OH)3 = Al3+ + 3H2O | |
| 4 | Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ соль |
2H+ + |
Да спецыфічных уласцівасцей салянай кіслаты варта аднесці рэакцыі, абумоўленыя наяўнасцю аніёна Сl–. Вылучым два найважнейшыя.
1. Рэакцыі акіслення хларыд-іонаў. Іон хлору ў складзе хлоравадароднай кіслаты мае найніжэйшую ступень акіслення –1 і здольны яе павышаць пры страце электронаў. Значыць, за кошт іонаў хлору кіслата з’яўляецца адноўнікам. Напрыклад, для атрымання хлору ў лабараторыі выкарыстоўваюць рэакцыю канцэнтраванай салянай кіслаты з моцнымі акісляльнікамі (МnO2, KМnO4, KClO3):
.
2. Рэакцыі звязвання аніёна Сl– з катыёнамі некаторых металаў, напрыклад свінцу Pb2+, серабра Ag+ у растворы. Гэта ілюструюць ураўненні рэакцый:
2HCl + Pb(NO3)2 = PbCl2↓ + 2HNO3;
Pb2+ + 2Cl– = PbCl2↓;
HCl + AgNO3 = AgCl↓ + HNO3;
Ag+ + Cl– = AgCl↓.
Дзеянне нітрату серабра(I) прыводзіць да ўтварэння белага тварожыстага асадку AgCl, што выкарыстоўваюць як тэст (якасная рэакцыя) на хларыд-іоны (Дадатак 3).
Супастаўленне ўласцівасцей галагенавадародных кіслот і іх солей
Фторавадарод HF з’яўляецца вадкасцю пры тэмпературах, ніжэйшых за 19 °С, а HCl, HBr, HI — газападобныя рэчывы пры н. у. (табл. 23). Рэзкае адрозненне НF па агрэгатным стане можна растлумачыць утварэннем вадародных сувязей паміж палярнымі малекуламі рэчыва: H—F … H—F … H—F … H—F.
Табліца 23. Галагенавадароды
| Галагенавадароды | HF | HCl | HBr | HI |
| Даўжыня сувязі, нм | 0,092 | 0,128 | 0,141 | 0,161 |
| Энергія сувязі, кДж/моль | 565 | 431 | 364 | 297 |
| Тэмпература плаўлення, °С | –83 | –114 | –87 | –51 |
| Тэмпература кіпення, °С | 19,5 | –85 | –67 | –35 |
| Агрэгатны стан (пры н. у.) | Вадкасць | Газ | Газ | Газ |

Асацыяты малекул фторавадароду настолькі трывалыя, што не разбураюцца (прысутнічаюць) нават у газавай фазе да 90 °С. Фторавадарод валодае неабмежаванай растваральнасцю ў вадзе. Яго раствор з’яўляецца слабай кіслатой (фторавадародная кіслата): . Нізкая сіла кіслаты НF абумоўлена высокай трываласцю (энергіяй) сувязі ў малекуле.
Плавіковая (фторавадародная) кіслата здольная разбураць («плавіць») шкло Na2O ∙ CaO ∙ 6SiO2 у адпаведнасці з ураўненнем:
6НF + SiO2 = H2SiF6 + 2H2O
або 4HF(г) + SiO2 SiF4↑ + 2H2O.
Астатнія галагенавадароды добра растваральныя ў вадзе і ўяўляюць сабой моцныя кіслоты: HBr → H++ Br–; HI → H+ + I–.
Большасць солей, якiя ўтвараюцца гэтымі кіслотамі, добра растваральныя ў вадзе. Для якаснага вызначэння ў растворах хларыд-, брамід- і ёдыд-іонаў выкарыстоўваюць рэакцыю з растворам нітрату серабра(I) AgNO3. Пры гэтым хларыды ўтвараюць белы тварожысты асадак AgCl, браміды — светла-жоўты AgBr, ёдыды — жоўты AgI (табл. 24, Дадатак 3):
Ag+ + Cl– = AgCl↓; Ag+ + Br– = AgBr↓; Ag+ + I– = AgI↓.
Гэтыя асадкі не раствараюцца ў азотнай кіслаце.
Нітрат серабра(I) не ўтварае асадку з растваральнымі фтарыдамі, таму фтарыд-іоны вызначаюць з дапамогай раствору CaCl2 (Дадатак 3):
CaCl2 + 2NaF = CaF2↓ + 2NaCl; Ca2+ + 2F–= CaF2↓.
Табліца 24. Якасныя рэакцыі на аніёны галагенавадародных кіслот
| Назва кіслаты і яе хімічная формула | Солі | Якасныя рэакцыі на аніёны | |||
| Іон | Рэактыў | Прыкмета рэакцыі | |||
| Фторавадародная (плавіковая) | HF | Фтарыды | F– фтарыд |
CaCl2 | Белы асадак CaF2 |
| Хлоравадародная (саляная) | HCl | Хларыды | Cl– хларыд |
AgNO3 | Белы тварожысты асадак AgCl |
| Бромавадародная | HBr | Браміды | Br– брамід |
AgNO3 | Светла-жоўты асадак AgBr |
| Ёдавадародная | HI | Ёдыды | I– ёдыд |
AgNO3 | Жоўты асадак AgI |
Прымяненне галагенаў і іх злучэнняў
Галагены знаходзяць вельмі шырокае прымяненне і як простыя рэчывы, і ў выглядзе злучэнняў. Гэта ілюструюць даныя табліцы 25.
Табліца 25. Ужыванне галагенаў і некаторых іх злучэнняў
| Галаген | Злучэнне | Найважнейшыя сферы ўжывання |
| Фтор | Na3[AlF6] (крыяліт)) | Вытворчасць алюмінію |
| NaF (фтарыд натрыю) | Дадатак да зубных пастаў. Медыцынскі прэпарат | |
| НF (плавіковая кіслата) | Шкляная прамысловасць. Вытворчасць алюмінію | |
| Тэрмастойкі палімер. Антыпрыгарнае пакрыццё для патэльняў, прасаў | ||
| Хлор | Cl2 (хлор) | Абеззаражванне пітной вады. Адбельванне льняных і баваўняных тканін. Арганічны сінтэз. Атрыманне каляровых металаў з руды. Атрыманне салянай кіслаты |
| NaClO (гіпахларыт натрыю) | Кампанент адбельвальных сродкаў | |
| НCl (саляная кіслата) | Хімічная прамысловасць | |
| NaCl (галіт)) | Харчовая дабаўка. Сыравіна для вытворчасці хлору, натрыю, гідраксіду натрыю | |
| Бром | Br2 (бром) | Арганічны сінтэз: вытворчасць антыпірэнаў (інгібітары гарэння), каўчуку, сродкаў аховы раслін. Вытворчасць медыцынскіх прэпаратаў |
| Ёд | I2 (ёд) | Медыцына — спіртавы раствор (5–10 %). Фармацэўтычная прамысловасць |
Хлор утрымліваецца ў вельмі небяспечным для жыцця і здароўя рэчыве — дыаксіне, які можа ўтварыцца ў выніку рэакцый арганічных рэчываў і хлору пры высокіх тэмпературах. Арганічныя злучэнні хлору і фтору (напрыклад, фрэону) вучоныя лічаць адной з прычын разбурэння азонавага слоя Зямлі.
Растворы галагенавадародаў з’яўляюцца кіслотамі.
Хлоравадарод атрымліваюць сінтэзам з простых рэчываў або дзеяннем канцэнтраванай сернай кіслаты на цвёрды хларыд натрыю.
Саляная кіслата з’яўляецца акісляльнікам за кошт вадароду і адноўнікам за кошт хлору.
Выявіць хларыд-, брамід- і ёдыд-іоны можна з дапамогай раствору нітрату серабра(I). Нерастваральныя галагеніды серабра адрозніваюцца колерам: AgCl — белы, AgBr — светла-жоўты, AgI — жоўты.
Пытанні, заданні, задачы
1. Запішыце хімічныя формулы і назавіце агрэгатны стан галагенавадародаў пры нармальных умовах.
2. З пераліку Mg(OH)2, FeCl2, FeCl3, Fe(NO3)3, HBr, HCl, MgCl2, ZnSO4 выпішыце формулы і назавіце рэчывы, якія пры дзеянні раствору AgNO3 утвараюць белы тварожысты асадак.
3. Вызначце ступені акіслення атамаў у злучэннях: KClO3, HClO4, Cl2, KCl. У якім з іх атамы хлору могуць выступаць толькі ў ролі адноўніку?
4. Вызначце масу хлоравадароду ў порцыі салянай кіслаты масай 50 г з масавай доляй рэчыва 12 %.
5. Разлічыце аб’ём хлоравадароду (н. у.), які можа вылучыцца пры дзеянні канцэнтраванай сернай кіслаты на хларыд натрыю масай 100 г.
6. Запішыце хімічныя формулы рэчываў, якія рэагуюць з салянай кіслатой: медзь, аксід медзі(II), аксід кальцыю, аксід вугляроду(IV), жалеза, гідраксід цынку, сульфат натрыю, карбанат натрыю. Растлумачце свой выбар. Складзіце ўраўненні адпаведных рэакцый.
7. Прапануйце план эксперыментальнага вызначэння раствораў ёдыду калію, браміду натрыю і фтарыду натрыю, якія знаходзяцца ў пранумараваных прабірках, выкарыстоўваючы:
- а) рэакцыі замяшчэння;
- б) рэакцыі абмену.
Запішыце ўраўненні адпаведных рэакцый у малекулярнай і іоннай формах.
8. Растлумачце прычыны парушэння паслядоўнай змены тэмператур кіпення галагенавадародаў на малюнку 44 у § 17.
9. Вызначце масавую долю рэчыва ў растворы, атрыманым пры растварэнні хлоравадароду аб’ёмам 40 дм3 (н. у.) у вадзе аб’ёмам 120 см3.
10. Для атрымання брому газападобны хлор прапусцілі праз раствор масай 2 кг з масавай доляй браміду калію 0,12 %. Разлічыце масу атрыманага брому.
*Самакантроль
1. Самай слабай кіслатой з’яўляецца:
- а) НF;
- б) HBr;
- в) HCl;
- г) HClO4.
2. Водны раствор фторавадароду ўтрымлівае часціцы:
- а) F–;
- б) Н+;
- в) НF;
- г) F2.
3. Саляная кіслата рэагуе з:
- а) Нg;
- б) AgNO3;
- в) Cu(ОН)2;
- г) Al.
4. Белы тварожысты і жоўты асадак адпаведна пры ўзаемадзеянні з нітратам серабра(I) утвараюць:
- а) NaBr і KI;
- б) KCl і KI;
- в) NaCl і HCl;
- г) HI і KI.
5. Газападобны хлоравадарод можна атрымаць узаемадзеяннем:
- а) Н2 і Cl2;
- б) NaCl(р-р) і H2SO4(р-р);
- в) KCl(р-р) і H2SO4(р-р);
- г) NaCl(цв) і H2SO4(канц).