§ 29.2. Пераксід вадароду
Самакантроль
1. Схема ўтварэння вадароднай сувязі паміж малекуламі вады і пераксіду вадароду:
а) 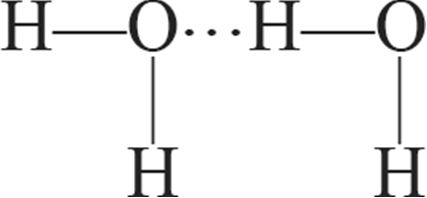
б) 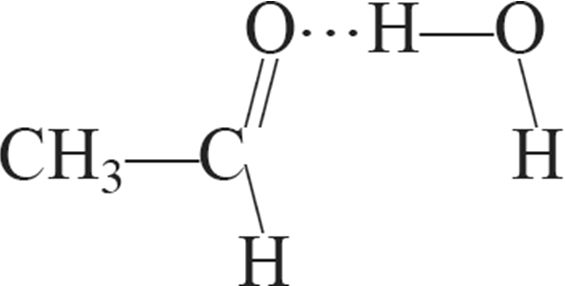

в) 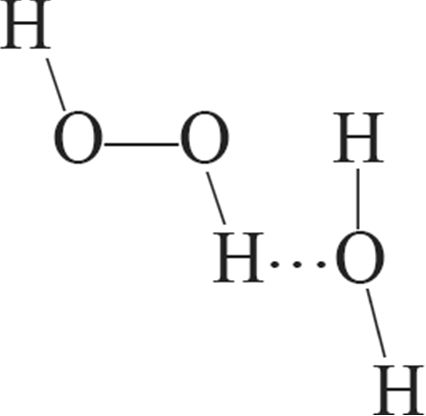

г)
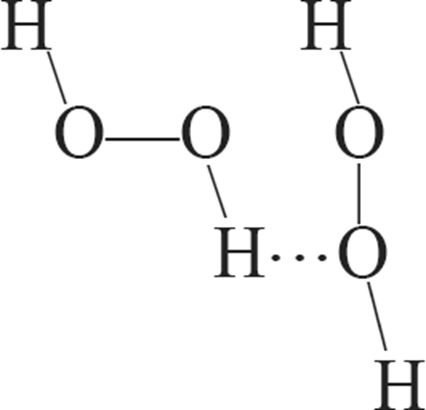
2. Сума каэфіцыентаў ва ўраўненні рэакцыі Н2О2 + PbS → H2O + PbSO4 роўная:
- а) 6;
- б) 9;
- в) 10;
- г) 14.
3. Ступень акіслення –1 маюць атамы кіслароду ў злучэннях:
- а) Na2О2;
- б) Н2О2;
- в) СаО2;
- г) K2О.
4. Пераксід вадароду ўтвараецца ў рэакцыях, схемы якіх:
- а) ВаО2 + НCl →;
- б) ВаО2 + H2SO4 →;
- в) Н2О2 + KMnO4 →;
- г) Н2О2 + H2S →.
5. Адносна пераксіду вадароду справядлівымі з’яўляюцца сцвярджэнні:
- а) малекула Н2О2 лінейная;
- б) у малекуле змешчаны дзве палярныя і адна непалярная кавалентная сувязь;
- в) праяўляе акісляльныя ўласцівасці ў адносінах да NaI;
- г) можна выкарыстоўваць для атрымання кіслароду ў лабараторыі.