§ 29.2. Пераксід вадароду
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 29.2. Пераксід вадароду |
| Напечатано:: | Гость |
| Дата: | Четверг, 14 Август 2025, 11:52 |
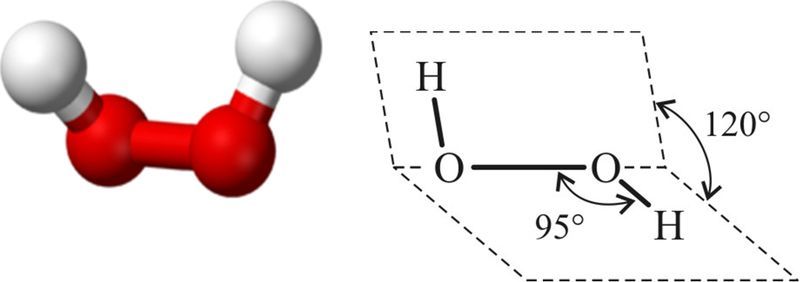
Пераксід вадароду Н2О2 — рэчыва малекулярнай будовы, структурная формула якога Н—О—О—Н. Будова малекулы паказана на малюнку 67.2.
Энергія сувязі Н—О складае 468 кДж/моль і амаль у два разы вышэйшая за энергію сувязі О—О (210 кДж/моль). Малекула несіметрычная і палярная. Паміж малекуламі існуюць вадародныя сувязі.
Фізічныя ўласцівасці
Пры пакаёвай тэмпературы пераксід вадароду — бледна-блакітная сіропападобная вадкасць. У параўнанні з вадой яна мае больш высокія тэмпературы кіпення і плаўлення: tкіп. = 150,2 °С, tпл. = 0,41 °С. Змешваецца з вадой у любых суадносінах, чаму спрыяе ўтварэнне вадародных сувязей з малекуламі вады. Раствор з масавай доляй H2O2 30 % называюць пергідролем. У побыце звычайна выкарыстоўваюць 3%-ны раствор.
Хімічныя ўласцівасці
Пераксід вадароду праяўляе слаба выражаныя кіслотныя ўласцівасці, а таксама ўступае ў акісляльна-аднаўленчыя рэакцыі. У акісляльна-аднаўленчых рэакцыях кісларод, маючы прамежкавую ступень акіслення –1, можа яе або паніжаць да –2, выконваючы ролю акісляльніку, або павышаць да 0, выступаючы адноўнікам.
1. Раствор пераксіду вадароду мае кіслую рэакцыю асяроддзя, што тлумачыцца ўтварэннем іонаў вадароду Н+ (гідраксонію (Н3О+):
або
Пераксід вадароду — вельмі слабая кіслата. Як кіслата H2O2 рэагуе з некаторымі шчолачамі, напрыклад Ba(OH)2:
Н2О2 + Ва(ОН)2 = ВаО2 + 2Н2О (пераксід барыю).
2. Пры захоўванні на святле, а таксама пры награванні, у прысутнасці каталізатараў (напрыклад, MnO2) H2O2 раскладаецца на кісларод і ваду:
,
таму пераксід вадароду і яго растворы захоўваюць у цёмным посудзе на холадзе, для стабілізацыі дадаюць інгібітары.
3. У рэакцыях з адноўнікам (напрыклад, KI–1) атамы кіслароду паніжаюць ступень акіслення:
;
.
4. У рэакцыях з моцнымі акісляльнікамі (напрыклад, KMnO4) атамы кіслароду павышаюць ступень акіслення:
Атрыманне. Пераксід вадароду ў лабараторыі можна атрымаць дзеяннем сернай кіслаты на пераксіды металаў:
BaО2 + H2SO4 = BaSO4↓ + Н2О2.
Выкарыстанне. Водныя растворы пераксіду вадароду выкарыстоўваюць як антысептык у медыцыне, як акісляльнік ракетнага паліва, для адбельвання тканін, у касметычных сродках для афарбоўкі валасоў. Яго дзеянне абумоўлена раскладаннем пад дзеяннем цеплаты, святла, а таксама некаторых іншых рэчываў з вылучэннем кіслароду. З пераксіду вадароду атрымліваюць іншыя пераксіды.
Пераксід вадароду Н2О2 праяўляе слаба выражаныя кіслотныя ўласцівасці. У акісляльна-аднаўленчых рэакцыях пераксід вадароду выступае як адноўнік і як акісляльнік.
Пытанні, заданні, задачы
1. Выпішыце формулы пераксідаў: Н2О, Н2О2, Na2О2, OF2, BaО2, CO2.
2. Складзіце электронную і структурную формулы пераксіду вадароду.
3. Дайце характарыстыку хімічных сувязей у малекуле пераксіду вадароду.
4. Запішыце ўраўненне рэакцыі раскладання пераксіду вадароду ў прысутнасці аксіду марганцу(IV). Ахарактарызуйце рэакцыю з пункту гледжання працэсаў акіслення і аднаўлення.
5. Да раствору пераксіду вадароду масай 75 г дадалі невялікую порцыю аксіду марганцу(IV). У выніку поўнага раскладання пераксіду вадароду вылучыўся газ аб’ёмам 0,5 дм3. Якая масавая доля пераксіду ў зыходным растворы?
6. Расстаўце каэфіцыенты метадам электроннага балансу:
KMnO4 + Н2О2 → MnO2 + KOH + Н2О + O2↑.
7. Прапануйце прадукты рэакцый паміж пераксідам вадароду і:
- а) гідраксідам жалеза(II),
- б) ёдыдам натрыю. Складзіце ўраўненні рэакцый і ўкажыце пераход электронаў.
8. Прапануйце малекулярную і структурную формулы дысульфану — вадароднага злучэння серы, якое з’яўляецца аналагам пераксіду вадароду (па саставе і будове). Складзіце ўраўненне рэакцыі яго раскладання на серавадарод і серу.
9. Вызначце рэчывы X, Y, Z у схеме:
, калі
.
10. Складзіце ўраўненні адпаведных рэакцый.
11. Разлічыце аб’ём раствору пераксіду вадароду з масавай доляй 3 % (шчыльнасць 1,01 г/см3), які можна прыгатаваць, маючы 1 дм3 пергідролю (шчыльнасць 1,112 г/см3, масавая доля Н2O2 30 %).
Самакантроль
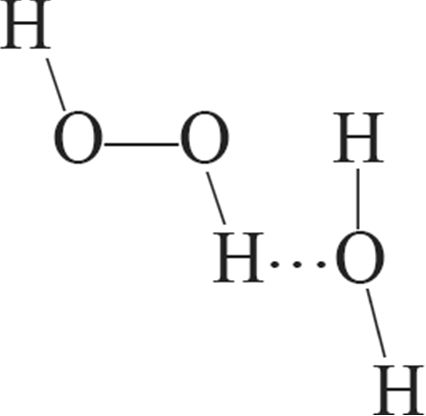
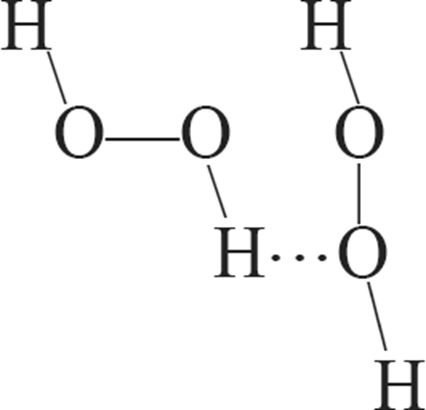
1. Схема ўтварэння вадароднай сувязі паміж малекуламі вады і пераксіду вадароду:
2. Сума каэфіцыентаў ва ўраўненні рэакцыі Н2О2 + PbS → H2O + PbSO4 роўная:
- а) 6;
- б) 9;
- в) 10;
- г) 14.
3. Ступень акіслення –1 маюць атамы кіслароду ў злучэннях:
- а) Na2О2;
- б) Н2О2;
- в) СаО2;
- г) K2О.
4. Пераксід вадароду ўтвараецца ў рэакцыях, схемы якіх:
- а) ВаО2 + НCl →;
- б) ВаО2 + H2SO4 →;
- в) Н2О2 + KMnO4 →;
- г) Н2О2 + H2S →.
5. Адносна пераксіду вадароду справядлівымі з’яўляюцца сцвярджэнні:
- а) малекула Н2О2 лінейная;
- б) у малекуле змешчаны дзве палярныя і адна непалярная кавалентная сувязь;
- в) праяўляе акісляльныя ўласцівасці ў адносінах да NaI;
- г) можна выкарыстоўваць для атрымання кіслароду ў лабараторыі.