§ 29.1. Вадародныя злучэнні неметалаў і металаў
Вадародныя злучэнні металаў
Вадародныя злучэнні шчолачных і шчолачназямельных металаў можна атрымаць прамым злучэннем простых рэчываў, напрыклад:
Н2 + 2Li = 2LiH;
Н2 + Вa = ВaH2.
Для гэтага вадарод пад ціскам прапускаюць над разагрэтым да 200−600 °С металам.
Найбольш распаўсюджаныя злучэнні вадароду з неметаламі, а таксама металамі IA- і IIA-груп паказаны на малюнку 67.1.
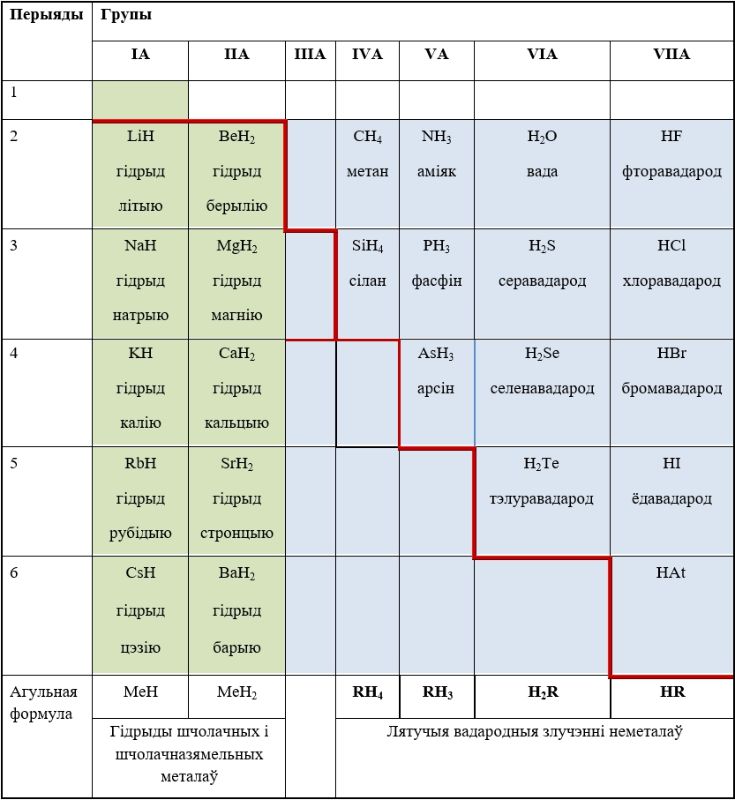
Вадародныя злучэнні металаў IA- і IIA-груп (s-элементаў, акрамя берылію) — іонныя гідрыды. Гэта белыя крышталічныя рэчывы з даволі высокімі тэмпературамі кіпення, іх расплавы электраправодныя.
Найважнейшай уласцівасцю гідрыдаў металаў з’яўляецца іх узаемадзеянне з вадой і кіслотамі з утварэннем вадароду:
LiH + Н2О = LiOH + H2↑;
СаН2 + 2НСl = CaCl2 + 2H2↑.
Іонныя гідрыды — гэта рэчывы, якія пры награванні раскладаюцца на метал і вадарод без плаўлення: 2NaH = 2Na + H2.
Выключэнне складаюць LiH і CaH2, якія плавяцца без раскладання, але пры далейшым награванні ўсё ж раскладаюцца.
Іонныя гідрыды металаў валодаюць аднаўленчымі ўласцівасцямі:
NaH + C2H5OH = C2H5ONa + H2.
Дзякуючы аднаўленчым уласцівасцям іонныя гідрыды выкарыстоўваюць для атрымання металаў з іх аксідаў або галагенідаў, выдалення акаліны з паверхні тугаплаўкіх металаў. Гідрыды — крыніцы вадароду і таму перспектыўныя як кампанент ракетнага паліва.
Пры ўзаемадзеянні іонных гідрыдаў з гідрыдамі алюмінію або бору ўтвараюцца комплексныя гідрыды. З іх найбольшае значэнне маюць борагідрыд натрыю Na[BH4] і алюмагідрыд літыю Li[AlH4] як моцныя адноўнікі:
2RCHO + 2Li[BH4] + 2H2O = 2RCH2OH + 2LiOH + B2H6↑ (аднаўленне альдэгідаў);
2Ni2+ + + 4OH− → 2Ni +
+ 2H2↑ (аднаўленне іонаў металаў у працэсах атрымання металічных пакрыццяў і парашкоў).