§ 29.1. Вадародныя злучэнні неметалаў і металаў
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 29.1. Вадародныя злучэнні неметалаў і металаў |
| Напечатано:: | Гость |
| Дата: | Четверг, 14 Август 2025, 09:05 |
Кіслотна-асноўныя ўласцівасці водных раствораў вадародных злучэнняў неметалаў
Разгледзім змену кіслотна-асноўных уласцівасцей водных раствораў лятучых вадародных злучэнняў у залежнасці ад становішча элемента ў перыядычнай сістэме. Вядома, што СН4 не раствараецца ў вадзе, NH3 утварае слабую аснову NH3 ∙ Н2O, а раствор НF — слабая кіслата:
NH3 ∙ Н2O
+ OН–;
Н2О Н+ + ОН–;
HF H+ + F–.
Значыць, кіслотныя ўласцівасці вадародных злучэнняў неметалаў у перыядзе з павелічэннем парадкавага нумара элемента ўзмацняюцца.
У групах кіслотныя ўласцівасці водных раствораў вадародных злучэнняў неметалаў таксама ўзмацняюцца: НF з’яўляецца слабай кіслатой, а HCl, HBr, HI — моцнымі.
Вуглярод і вадарод утвараюць значную колькасць бінарных арганічных злучэнняў розных класаў: алканы СnH2n+2, алкены СnH2n, алкіны СnH2n–2, арэны СnH2n–6 і інш.
Кісларод утварае два ўстойлівыя злучэнні з вадародам — Н2О и Н2О2 (вада і пераксід вадароду).
Для серы вядомы рад вадародных злучэнняў саставу Н2Sn (n = 1–20), напрыклад, Н2S, Н2S2.
Вадародныя злучэнні металаў
Вадародныя злучэнні шчолачных і шчолачназямельных металаў можна атрымаць прамым злучэннем простых рэчываў, напрыклад:
Н2 + 2Li = 2LiH;
Н2 + Вa = ВaH2.
Для гэтага вадарод пад ціскам прапускаюць над разагрэтым да 200−600 °С металам.
Найбольш распаўсюджаныя злучэнні вадароду з неметаламі, а таксама металамі IA- і IIA-груп паказаны на малюнку 67.1.
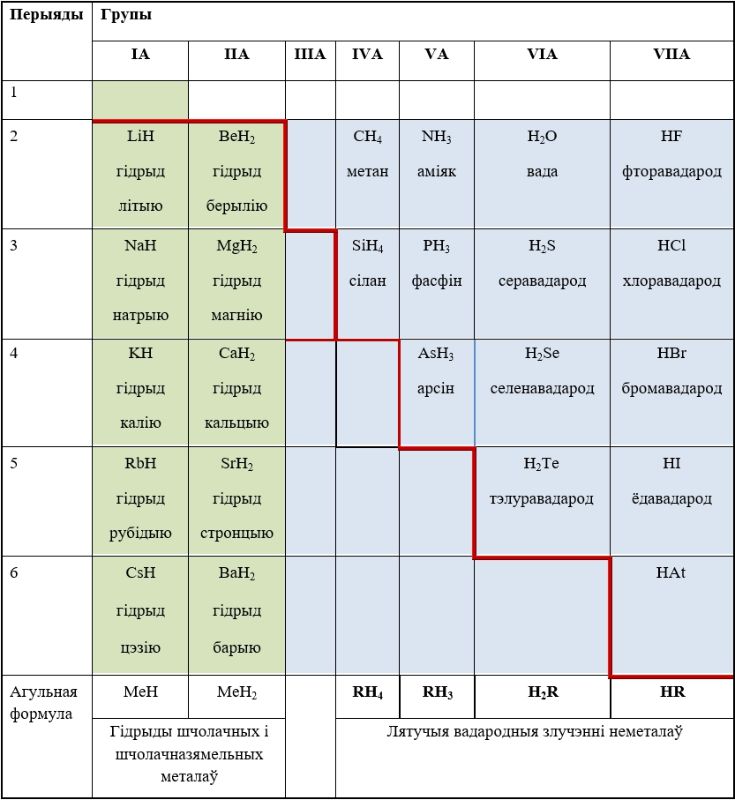
Вадародныя злучэнні металаў IA- і IIA-груп (s-элементаў, акрамя берылію) — іонныя гідрыды. Гэта белыя крышталічныя рэчывы з даволі высокімі тэмпературамі кіпення, іх расплавы электраправодныя.
Найважнейшай уласцівасцю гідрыдаў металаў з’яўляецца іх узаемадзеянне з вадой і кіслотамі з утварэннем вадароду:
LiH + Н2О = LiOH + H2↑;
СаН2 + 2НСl = CaCl2 + 2H2↑.
Іонныя гідрыды — гэта рэчывы, якія пры награванні раскладаюцца на метал і вадарод без плаўлення: 2NaH = 2Na + H2.
Выключэнне складаюць LiH і CaH2, якія плавяцца без раскладання, але пры далейшым награванні ўсё ж раскладаюцца.
Іонныя гідрыды металаў валодаюць аднаўленчымі ўласцівасцямі:
NaH + C2H5OH = C2H5ONa + H2.
Дзякуючы аднаўленчым уласцівасцям іонныя гідрыды выкарыстоўваюць для атрымання металаў з іх аксідаў або галагенідаў, выдалення акаліны з паверхні тугаплаўкіх металаў. Гідрыды — крыніцы вадароду і таму перспектыўныя як кампанент ракетнага паліва.
Пры ўзаемадзеянні іонных гідрыдаў з гідрыдамі алюмінію або бору ўтвараюцца комплексныя гідрыды. З іх найбольшае значэнне маюць борагідрыд натрыю Na[BH4] і алюмагідрыд літыю Li[AlH4] як моцныя адноўнікі:
2RCHO + 2Li[BH4] + 2H2O = 2RCH2OH + 2LiOH + B2H6↑ (аднаўленне альдэгідаў);
2Ni2+ + + 4OH− → 2Ni +
+ 2H2↑ (аднаўленне іонаў металаў у працэсах атрымання металічных пакрыццяў і парашкоў).
Кіслотныя ўласцівасці водных раствораў вадародных злучэнняў неметалаў у перыядах узмацняюцца.
Гідрыды s-элементаў (металаў) — іонныя злучэнні. Яны валодаюць аднаўленчымі ўласцівасцямі, гідралізуюцца і рэагуюць з кіслотамі з утварэннем вадароду.
Пытанні, заданні, задачы
1. Назавіце агульныя формулы вадародных злучэнняў элементаў VIIA-, VIA-, VA- і IVA-груп.
2. Выпішыце формулы вадародных злучэнняў з кавалентнай сувяззю: HCl, СаН2, Н2Se, LiH, HF, BaH2, NaH.
3. Вызначце ступені акіслення атамаў у наступных гідрыдах:
- а) HBr, BаН2, Н2S, NH3;
- б) HF, H2S, NaH, CaH2.
4. Складзіце ўраўненні сінтэзу гідрыдаў, указаных у заданні 3.
5. Назавіце вадародныя злучэнні неметалаў, паміж малекуламі якіх існуе моцная вадародная сувязь. Растлумачце прычыну гэтай з’явы.
6. Складзіце ўраўненні рэакцый паміж гідраксідам калію і вадароднымі злучэннямі фтору і ёду ў малекулярнай і іоннай формах. Чаму сума каэфіцыентаў ва ўраўненнях, напісаных у іоннай форме, розная?
7. Складзіце ўраўненні рэакцый паводле схемы:
- a)
;
- б)
.
Дайце характарыстыку рэакцыям 1* па вядомых вам класіфікацыйных прыкметах.
8. Ёсць рад вадародных злучэнняў: NaH, BaН2, Н2О, NН3, HCl. Якія з іх за кошт атамаў вадароду могуць праяўляць уласцівасці:
- а) аднаўленчыя;
- б) акісляльныя?
9. Бінарнае злучэнне кальцыю і неметалу VА-групы масай 1,82 г пры дзеянні вады ўтварае газ аб’ёмам 448 см3 (н. у.). Вызначце хімічную формулу газападобнага злучэння.
10. Сумесь, якая змяшчае хлор масай 35,5 г і вадарод масай 1,5 г, падпалілі. Вызначце аб’ёмныя долі кожнага з кампанентаў у сумесі газаў пасля заканчэння рэакцыі.
Самакантроль
1. Лятучымі вадароднымі злучэннямі з’яўляюцца рэчывы, формулы якіх:
- а) NaH;
- б) HF;
- в) СН4;
- г) HCl.
2. Кіслотныя ўласцівасці ўзмацняюцца ў водных растворах злучэнняў у радзе:
- а) NН3, СН4, HF;
- б) HF, СН4, NН3;
- в) NН3, HF, HCl;
- г) HCl, HF, СН4.
3. Пры растварэнні ў вадзе ўтвараюць шчолач злучэнні:
- а) NaH;
- б) HI;
- в) SrH2;
- г) HCl.
4. Атамы вадароду могуць праяўляць толькі акісляльныя ўласцівасці ў саставе:
- а) NaH;
- б) HBr;
- в) Н2S;
- г) Н2.
5. У чатырох прабірках знаходзяцца дыстыляваная вада, а таксама прадукты растварэння ў вадзе аміяку, бромавадароду і гідрыду кальцыю. Вынікі выпрабавання змесціва прабірак універсальным індыкатарам наступныя:
 |
1 – рН = 10 |
| 2 – рН = 7 | |
| 3 – рН = 13 | |
| 4 – рН = 2 |
Вада і раствор бромавадароду знаходзяцца ў прабірках:
- а) 1 і 2;
- б) 2 і 3;
- в) 2 і 4;
- г) 1 і 4.