§ 28. Агульная характарыстыка неметалаў
Будова электронных абалонак атамаў неметалаў
Знешні электронны слой атама шмат у чым вызначае ўласцівасці элемента. Лік электронаў знешняга ўзроўню атамаў неметалаў адпавядае нумару А-групы, у якой размешчаны элемент. У большасці з іх ён блізкі да завяршэння або завершаны, змяшчае чатыры і больш электронаў. Меншы лік электронаў утрымліваюць атамы толькі трох элементаў: вадарод мае адзін электрон (да завяршэння не хапае аднаго электрона), гелій — два электроны (знешні ўзровень завершаны), бор — тры электроны. Неметалы з’яўляюцца прадстаўнікамі p-элементаў, за выключэннем вадароду і гелію, якія належаць да s-элементаў.
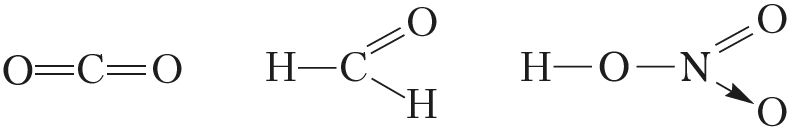
Атамы неметалаў, у адрозненне ад атамаў металаў, здольныя праяўляць як дадатныя ступені акіслення, так і адмоўныя. Выключэнні — фтор і высакародныя газы. У злучэннях з іншымі элементамі для фтору характэрна толькі адмоўная ступень акіслення, роўная –1 (напрыклад, ,
,
). Найбольш лёгкія высакародныя газы — гелій, неон і аргон — устойлівых злучэнняў не ўтвараюць, а для ксенону, крыптону і радону атрыманы злучэнні толькі з дадатнымі ступенямі акіслення (напрыклад,
,
).
У цэлым значэнні ступеняў акіслення неметалаў ляжаць у інтэрвале ад –4 да +8, а валентнасці — ад I да VIII. Варта ўспомніць, што валентнасць атамаў элементаў другога перыяду не бывае большай за чатыры: