§ 28. Агульная характарыстыка неметалаў
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 28. Агульная характарыстыка неметалаў |
| Напечатано:: | Гость |
| Дата: | Понедельник, 11 Август 2025, 12:13 |
Становішча ў перыядычнай сістэме
Хімічныя элементы прынята дзяліць на металы і неметалы паводле іх хімічных уласцівасцей. У перыядычнай сістэме неметалы размешчаны ў А-групах: IА, IIIА–VIIIА. Ад металаў іх аддзяляе ступеньчатая лінія вадарод — бор — аганесон. Неметалы знаходзяцца вышэй ад гэтай лініі, гэта значыць займаюць правы верхні вугал табліцы, утвараючы своеасаблівы трохвугольнік (мал. 61).
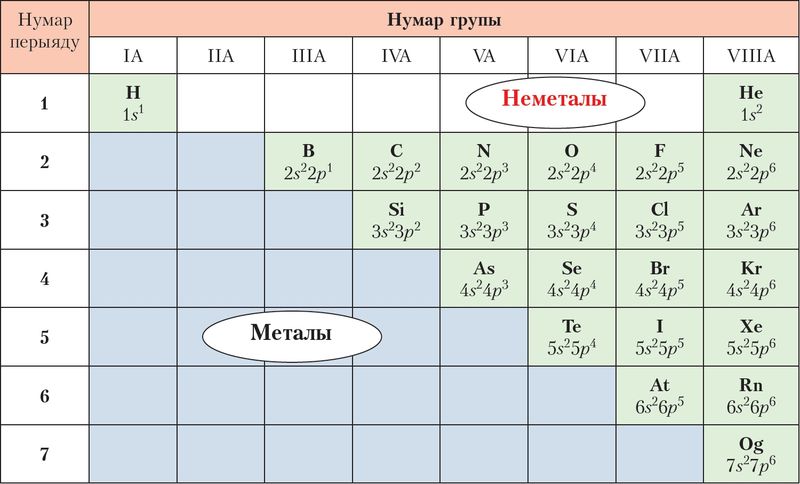
Элементы, размешчаныя ў адной групе, падобныя па будове атама, а значыць, шмат у чым і па ўласцівасцях. Таму для некаторых груп неметалаў ужываюць агульныя назвы. Так, неметалы VIIIA-групы называюць высакароднымі газамі. Для элементаў VIIA-групы выкарыстоўваюць назву галагены — якія нараджаюць солі. Неметалы VIA-групы маюць агульную назву халькагены — якія нараджаюць руды.
Паводле электрафізічных уласцівасцей, у адрозненне ад хімічных, простыя рэчывы, што складаюцца з атамаў тых ці іншых элементаў, падзяляюць на тры групы: металы, паўправаднікі і дыэлектрыкі. Адрозніць гэтыя рэчывы можна не толькі па велічыні электраправоднасці, але і па характары яе залежнасці ад тэмпературы. З ростам тэмпературы электраправоднасць металаў падае, а паўправаднікоў і дыэлектрыкаў расце. Тыповыя паўправаднікі — крэмній і германій.
Будова электронных абалонак атамаў неметалаў
Знешні электронны слой атама шмат у чым вызначае ўласцівасці элемента. Лік электронаў знешняга ўзроўню атамаў неметалаў адпавядае нумару А-групы, у якой размешчаны элемент. У большасці з іх ён блізкі да завяршэння або завершаны, змяшчае чатыры і больш электронаў. Меншы лік электронаў утрымліваюць атамы толькі трох элементаў: вадарод мае адзін электрон (да завяршэння не хапае аднаго электрона), гелій — два электроны (знешні ўзровень завершаны), бор — тры электроны. Неметалы з’яўляюцца прадстаўнікамі p-элементаў, за выключэннем вадароду і гелію, якія належаць да s-элементаў.
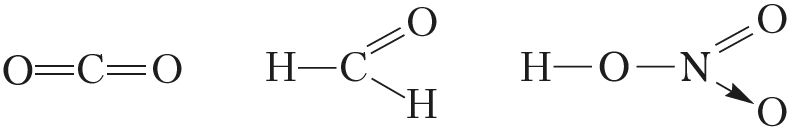
Атамы неметалаў, у адрозненне ад атамаў металаў, здольныя праяўляць як дадатныя ступені акіслення, так і адмоўныя. Выключэнні — фтор і высакародныя газы. У злучэннях з іншымі элементамі для фтору характэрна толькі адмоўная ступень акіслення, роўная –1 (напрыклад, ,
,
). Найбольш лёгкія высакародныя газы — гелій, неон і аргон — устойлівых злучэнняў не ўтвараюць, а для ксенону, крыптону і радону атрыманы злучэнні толькі з дадатнымі ступенямі акіслення (напрыклад,
,
).
У цэлым значэнні ступеняў акіслення неметалаў ляжаць у інтэрвале ад –4 да +8, а валентнасці — ад I да VIII. Варта ўспомніць, што валентнасць атамаў элементаў другога перыяду не бывае большай за чатыры:
Простыя рэчывы
У класіфікацыі элементаў, што гістарычна склалася, прыналежнасць да неметалаў вызначалі па фізічных уласцівасцях простых рэчываў: цвёрды, газападобны або вадкі стан пры нармальных умовах. У цвёрдым стане ў неметалаў, як правіла, адсутнічае металічны бляск. Іх электра- і цеплаправоднасць звычайна невялікія, рэчывы з’яўляюцца крохкімі.
Неметалы ўтвараюць два тыпы крышталёў — малекулярныя і атамныя (мал. 62).
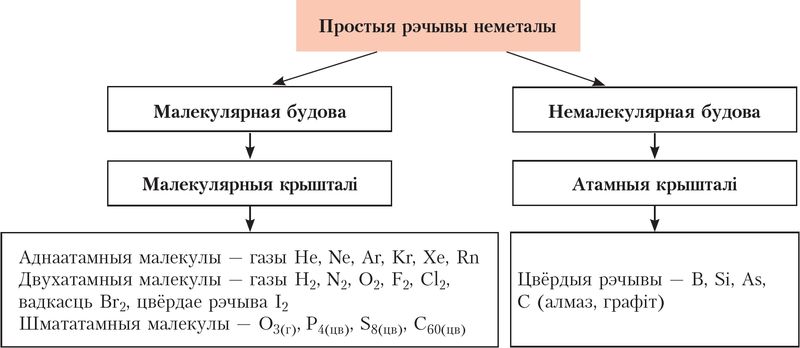
Рэчывы малекулярнай будовы адрозніваюцца нізкімі тэмпературамі плаўлення (гелій –272 °С, кісларод –223 °С) і кіпення (гелій –269 °С, кісларод –183 °С). Неметалы немалекулярнай будовы, наадварот, маюць надзвычай высокія тэмпературы кіпення і плаўлення (графіт: Tпл. = 3850 °С, Tкіп. = 4200 °С).
Для неметалаў характэрна з’ява алатропіі. Прыкладамі могуць служыць чырвоны і белы фосфар, алмаз і графіт, кісларод і азон.
Неметалы могуць уступаць у рэакцыі з рэчывамі ўсіх класаў (металамі, іншымі неметаламі, аксідамі, шчолачамі, кіслотамі, солямі) і праяўляць як акісляльныя, так і аднаўленчыя ўласцівасці (табл. 20).
Табліца 20. Агульныя ўласцівасці неметалаў як простых рэчываў
| Неметалы як акісляльнікі ўступаюць у рэакцыі | Неметалы як адноўнікі ўступаюць у рэакцыі |
| З металамі: |
З некаторымі аксідамі: |
| З іншымі неметаламі: |
З іншымі неметаламі: |
| З кіслотамі: |
З арганічнымі рэчывамі: |
| З солямі: |
Акісляльныя здольнасці атамаў неметалаў можна параўноўваць па становішчы ў перыядычнай сістэме: з ростам атамнага нумара яны павялічваюцца ў перыядах і памяншаюцца, як правіла, у групах. Гэтыя ж уласцівасці можна таксама ацэньваць, супастаўляючы электраадмоўнасць неметалаў, якая ўзрастае ў радзе:
| Si | B | As | As | H | C | I | S | Br | Cl | N | O | F |
| 1,9 | 2,0 | 2,1 | 2,2 | 2,2 | 2,5 | 2,5 | 2,6 | 2,8 | 3,0 | 3,0 | 3,5 | 4,0 |
Акісляльная здольнасць неметалаў з павелічэннем электраадмоўнасці ўзмацняецца.
Распаўсюджанасць неметалаў у прыродзе
У прыродзе неметалы існуюць не толькі ў выглядзе злучэнняў (арганічныя рэчывы, аксіды Н2О, SiO2, СО2, солі бескіслародных кіслот NaCl, As2S3, солі кіслародзмяшчальных кіслот СаСО3, Са3(РО4)2), але і ў свабодным выглядзе, напрыклад азот, кісларод, высакародныя газы, вуглярод (у форме графіту і алмазу), сера. Існаванне неметалаў у выглядзе простых рэчываў у прыродзе звязана з нізкай актыўнасцю пералічаных неметалаў пры нармальных умовах: атамы высакародных газаў маюць завершаны знешні электронны ўзровень, кісларод і азот — даволі трывалыя кавалентныя сувязі ў двухатамных малекулах, вуглярод утварае трывалыя атамныя крышталі. На Зямлі самымі распаўсюджанымі неметаламі з’яўляюцца кісларод і крэмній (па масе каля 49 % і 26 % адпаведна), у Сусвеце — вадарод.
Прымяненне неметалаў
Сферы прымянення простых рэчываў неметалаў шырокія. Прыкладамі могуць служыць: вытворчасць паўправадніковых матэрыялаў (крэмній, селен), металургічныя працэсы атрымання металаў (вуглярод, вадарод) і сплаваў (бор, крэмній), інтэнсіфікацыя працэсаў гарэння (кісларод), стварэнне інертнай атмасферы (азот, высакародныя газы), арганічны сінтэз (хлор, бром), паветраплаванне (гелій, вадарод), святлатэхніка (высакародныя газы).
Неметалы з’яўляюцца прадстаўнікамі s- і р-элементаў.
Ступені акіслення неметалаў змяняюцца ад –4 да +8.
У хімічных рэакцыях неметалы праяўляюць як акісляльныя, так і аднаўленчыя ўласцівасці.
Пытанні, заданні, задачы
1. Апішыце становішча неметалаў у перыядычнай сістэме. Пакажыце для элементаўнеметалаў трэцяга перыяду магчымыя значэнні ступені акіслення і валентнасці.
2. Запішыце сімвалы элементаў і агульную формулу электроннай канфігурацыі:
- а) высакародных газаў;
- б) галагенаў;
- в) халькагенаў.
3. Вызначце ступені акіслення атамаў у злучэннях:
- а) НСl, HClO, HClO3, HClO4;
- б) H2S, SO2, H2SO3, H2SO4.
4. Укажыце сцвярджэнні, якія характарызуюць кісларод як хімічны элемент:
- а) аб’ёмная доля кіслароду ў паветры складае 21 %;
- б) атам кіслароду змяшчае шэсць электронаў на знешнім энергетычным узроўні;
- в) масавая доля кіслароду ў зямной кары роўная 49 %;
- г) пры выплаўленні чыгуну выкарыстоўваюць паветра, узбагачанае кіслародам; д) электраадмоўнасць кіслароду меншая, чым фтору;
- е) кісларод у злучэннях праяўляе ступені акіслення ад –2 да +2.
5. Складзіце ўраўненні рэакцый з удзелам неметалаў, улічваючы, што атамы неметалаў у зададзеных рэакцыях праяўляюць найніжэйшую ступень акіслення:
- Al + Cl2 →;
- Li + N2 →;
- Ca + P →;
- Zn + Br2 →;
- K + H2 →;
- Al + S →.
6. Вызначце масу вугляроду, неабходнага для аднаўлення жалеза з аксіду жалеза(III) масай 1 т. Вуглярод акісляецца да найвышэйшай ступені акіслення.
7. Азот мае вельмі нізкія тэмпературы плаўлення і кіпення –210 °C і –196 °C, а бор высокія — ≈2075 °C і ≈3800 °C адпаведна. Дайце тлумачэнне такому адрозненню.
8. Дакажыце, што фосфар выконвае функцыю адноўніку ў першай рэакцыі і акісляльніку — у другой:
- 1) Р + О2 → Р2О5;
- 2) Р + Са → Са3Р2.
9. Расстаўце каэфіцыенты метадам электроннага балансу і пакажыце, акісляльнікам або адноўнікам з’яўляюцца простыя рэчывы:
- а) Р + H2SO4 → H3PO4 + SO2 + H2O;
- б) S + HNO3 → H2SO4 + NO.
10. Узор газападобнага простага рэчыва неметалу аб’ёмам 1 дм3 (н. у.) мае масу 3,17 г. Вызначце хімічную формулу рэчыва.
*Самакантроль
1. Канфігурацыю знешняга электроннага ўзроўню ns2np5 маюць:
- а) азот;
- б) хлор;
- в) ёд;
- г) фосфар.
2. Крэмній як хімічны элемент характарызуюць сцвярджэнні:
- а) крэмній выкарыстоўваюць у вытворчасці паўправадніковых прыбораў;
- б) крэмній займае 2-е месца па распаўсюджанасці ў зямной кары;
- в) крэмній не ўзаемадзейнічае з вадародам непасрэдна;
- г) найвышэйшая ступень акіслення крэмнію +4.
3. Дадатную ступень акіслення праяўляюць элементы VA-групы ў злучэннях:
- а) HNO3;
- б) NH3;
- в) Li3N;
- г) H3PO4.
4. Сера з’яўляецца акісляльнікам, рэагуючы з:
- а) Ca;
- б) Al;
- в) F2;
- г) Fe.
5. Сума каэфіцыентаў у рэакцыі сінтэзу фасфіду кальцыю з простых рэчываў роўная:
- а) 3;
- б) 4;
- в) 5;
- г) 6.