§ 27.1. Гідроліз солей
Класіфікацыя солей па іх схільнасці да рэакцыі гідролізу
Любая соль можа быць прадстаўлена як прадукт рэакцыі нейтралізацыі (ад лац. neuter — ні той, ні іншы) пры ўзаемадзеянні кіслаты і асновы. Кіслоты і асновы могуць быць як моцнымі, так і слабымі электралітамі.
Рэакцыя нейтралізацыі — гэта рэакцыя абмену паміж кіслатой і асновай з утварэннем солі і вады:
KOH + HF = KF + H2O.
Кіслоты і асновы як электраліты адрозніваюцца па сваёй сіле. Напрыклад, солі амонію можна разглядаць як утвораныя ў рэакцыі з удзелам слабай асновы — гідрату аміяку NH3 · H2O. Соль KF утворана моцнай асновай KОН і слабай кіслатой HF, сульфід амонію — слабай асновай і слабай кіслатой.
У залежнасці ад сілы асновы і кіслаты можна вылучыць чатыры тыпы солей (мал. 60.1).
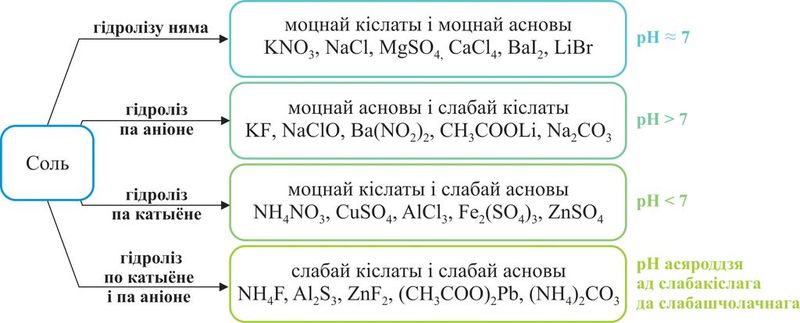
Разгледзім гідроліз солей усіх чатырох тыпаў.
Солі, утвораныя моцнай асновай і слабай кіслатой. У якасці прыкладу можна прывесці ацэтат натрыю CH3COONa. Гэтая соль утворана моцнай асновай NaОН і слабай кіслатой CH3COOH:
NaОН + CH3COOH = CH3COONa + H2O.
У водным растворы ацэтату натрыю працякаюць два працэсы:
а) поўная дысацыяцыя моцнага электраліту — солі CH3COONa на катыён і аніён:
CH3COONa → Na+ + CH3COO–;
б) узаемадзеянне ацэтат-іонаў з малекуламі вады з утварэннем слабага электраліту — воцатнай кіслаты:
CH3COO– + H2О CH3COOH + ОН–.
Лішак аніёнаў ОН– назапашваецца ў растворы і стварае слабашчолачнае асяроддзе, што сведчыць аб працяканні гідролізу па аніёне CH3COO–.
Ураўненне гідролізу ацэтату натрыю паказвае, што:
- а) у растворы канцэнтрацыя гідраксід-аніёнаў большая, чым у чыстай вадзе, таму раствор СH3COONa мае слабашчолачнае асяроддзе (pH > 7);
- б) у рэакцыі абмену з вадой і ва ўтварэнні слабай кіслаты ўдзельнічаюць толькі аніёны СH3COO–, таму гавораць, што гідроліз ідзе па аніёне.
Раўнавага гідролізу ў дадзеным прыкладзе моцна зрушана ўлева — у бок утварэння зыходных рэчываў, бо вада — значна больш слабы электраліт, чым воцатная кіслата СH3COOH.
Гідроліз з’яўляецца рэакцыяй, адваротнай нейтралізацыі.
Прыклады аніёнаў слабых кіслот, солі якіх гідралізуюцца вадой:
- а) аніёны слабых аднаасноўных кіслот: HCOO–,
, F–;
- б) аніёны слабых шматасноўных кіслот: S2–,
,
,
,
.
Разгледзім гідроліз карбанату натрыю Na2СO3 — солі моцнай асновы NaOH і слабай двухасноўнай кіслаты H2CO3. Гідроліз працякае па аніёне у адпаведнасці з ураўненнем у поўнай іоннай форме:
2Na+ + + H2O
2Na+ +
+ OH–.
Ураўненне ў скарочанай іоннай форме выглядае так:
+ H2O
+ OH–.
У растворы Na2СO3 утвараецца лішак гідраксід-аніёнаў і ствараецца шчолачнае асяроддзе. Раствор Na2CO3 з канцэнтрацыяй 0,1 моль/дм3 мае рН каля 11,5.
Солі, утвораныя моцнай кіслатой і слабай асновай. Разгледзім гідроліз хларыду амонію NH4Cl. Гэта соль моцнай кіслаты — HCl і слабай асновы — гідрату аміяку NH3 · H2O.
У водным растворы солі працякаюць два працэсы:
а) поўная дысацыяцыя моцнага электраліту — солі NH4Cl:
NH4Cl → + Cl–;
б) узаемадзеянне іонаў амонію з малекуламі вады з утварэннем слабага электраліту — гідрату аміяку NH3 · H2O:
+ H2O
NH3 · H2O + H+.
Гэтае ўраўненне паказвае, што:
- а) у растворы назапшаюцца катыёны вадароду Н+ і іх канцэнтрацыя становіцца большай, чым у чыстай вадзе, таму раствор NH4Cl мае кіслае асяроддзе (pH < 7);
- б) у рэакцыі абмену з вадой з утварэннем слабай асновы ўдзельнічаюць толькі катыёны амонію
, таму кажуць, што ідзе гідроліз па катыёне.
У рэакцыю з вадой могуць уступаць і шматзарадныя катыёны: двухзарадныяNi2+, Cu2+, Zn2+, Mn2+, Fe2+, Co2+, Pb2+ (акрамя катыёнаў Mg2+, Ca2+, Sr2+, Ba2+), трохзарадныя Fe3+, Al3+, Сr3+.
Разгледзім гідроліз нітрату медзі(II) Сu(NO3)2. Гэта соль моцнай кіслаты — HNO3 і слабай асновы — Cu(OH)2.
У гэтым выпадку прынята гаварыць, што гідроліз солі адбываецца па катыёне Cu2+. Ураўненне гідролізу ў поўнай іоннай форме:
Cu2+ + + H2O
Cu(OH)+ +
+ H+.
Ураўненне гідролізу ў скарочанай іоннай форме:
Cu2+ + H2O Cu(OH)+ + H+.
Прадуктамі гідролізу з’яўляюцца асноўная соль Cu(OH)NO3 і азотная кіслата HNO3.
Асяроддзе воднага раствору нітрату медзі(II) кіслае (pH ≈ 4,5), паколькі ў растворы ёсць лішак катыёнаў Н+.
Солі, утвораныя слабай асновай і слабай кіслатой. Такія солі падвяргаюцца гідролізу і па катыёне, і па аніёне. Пры гэтым іоны Н+, якія з’яўляюцца пры гідролізе па катыёне, звязваюцца ўтворанымі пры гідролізе па аніёне іонамі ОН–, што ўзмацняе гідроліз. Нярэдка гэтая рэакцыя неабарачальная. Напрыклад, сульфід алюмінію Al2S3 у вадзе падвяргаецца неабарачальнаму гідролізу з утварэннем нерастваральнага гідраксіду алюмінію і газападобнага серавадароду:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑.
Таму сульфід алюмінію Al2S3 нельга атрымаць рэакцыяй абмену паміж воднымі растворамі дзвюх солей, напрыклад нітрату алюмінію Al(NO3)3 і сульфіду калію K2S.
Магчымыя і іншыя выпадкі незваротнага гідролізу. Іх няцяжка прадказаць, бо для незваротнасці працэсу неабходна, каб прынамсі адзін з прадуктаў гідролізу сыходзіў са сферы рэакцыі. Прывядзём прыклад сумеснага неабарачальнага гідролізу катыёнаў Al3+ і аніёнаў :
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaNO3 + 3CO2↑.
Для солей, якія падвяргаюцца неабарачальнаму гідролізу, у табліцы «Растваральнасць кіслот, асноў і солей у вадзе» вы знойдзеце заўвагу: «не існуюць у водным растворы».
Падвядзём вынік таму, што вы даведаліся пра гідроліз і па катыёне, і па аніёне:
- а) калі солі гідралізуюцца па катыёне і аніёне адначасова, то раўнавага ў гэтай рэакцыі больш зрушана ўправа, чым для гідролізу гэтых іонаў паасобку;
- б) становішча раўнавагі рэакцыі гідролізу па катыёне і аніёне не залежыць ад канцэнтрацыі солі (дакажыце гэта самастойна);
- в) рэакцыя асяроддзя пры гэтым відзе гідролізу можа быць нейтральнай, слабакіслай або слабашчолачнай, што залежыць ад сілы ўтвораных асновы і кіслаты (слабакіслае асяроддзе сведчыць, што аснова з’яўляецца больш слабым электралітам, чым кіслата, а слабашчолачнае асяроддзе — наадварот);
- г) солі могуць неабарачальна гідралізавацца па катыёне і аніёне пры ўмове, што прынамсі адзін з прадуктаў гідролізу сыходзіць са сферы рэакцыі.
Абагульнім інфармацыю пра гідроліз сярэдніх солей па катыёнам і аніёнам у табліцы 19.1.
Табліца 19.1. Параўнанне солей па гідралізуемасці
| Гідралізавальнасць | Не схільныя да гідролізу | Схільныя да слабага гідролізу і пералічаныя ў парадку яго ўзмацнення | Схільныя да моцнага гідролізу і пералічаныя ў парадку яго ўзмацнення |
| Катыёны | K+, Na+, Li+, Ba2+, Sr2+, Ca2+, Mg2+, Ag+ | Mn2+, Co2+, Zn2+, Ni2+, Fe2+, Pb2+, Cu2+, Be2+ | Al3+, Cr3+, Sn2+, Fe3+ |
| Аніёны | Cl–, Br–, I–, |
F–, |
Не гідралізуюцца: растваральныя галагеніды (акрамя фтарыдаў), нітраты, перхлараты, сульфаты і перманганаты шчолачных і шчолачназямельных металаў.
Адзначым, што рэакцыі абарачальнага гідролізу падпарадкоўваюцца прынцыпу Ле Шатэлье, таму гідроліз солі можна як узмацніць, так і аслабіць.