§ 27.1. Гідроліз солей
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 27.1. Гідроліз солей |
| Напечатано:: | Гость |
| Дата: | Вторник, 12 Август 2025, 12:47 |
Паняцце аб рэакцыях гідролізу
У водным растворы часціцы растворанага рэчыва ўзаемадзейнічаюць з малекуламі вады. Такое ўзаемадзеянне нярэдка прыводзіць да рэакцыі гідролізу (ад ст.-грэч. hydro — вада + lysis — раскладанне).
Гідроліз — гэта хімічная рэакцыя ўзаемадзеяння рэчыва з вадой, пры якім адбываецца раскладанне малекул гэтага рэчыва і вады з ўтварэннем новых злучэнняў.
Гідроліз злучэнняў розных класаў — солей, вугляводаў, галагеналканаў, бялкоў, складаных эфіраў (у тым ліку тлушчаў) і іншых істотна адрозніваецца. З гідролізам галагеналканаў, бялкоў (поліпептыдаў), ды- і поліцукрыдаў (на прыкладзе цукрозы, крухмалу і цэлюлозы), а таксама складаных эфіраў вы пазнаёміліся ў курсе арганічнай хіміі. У гэтым раздзеле мы разгледзім гідроліз неарганічных рэчываў — солей.
Гідроліз солей — гэта абменнае ўзаемадзеянне паміж малекуламі вады і катыёнамі або аніёнамі солі, якое прыводзіць да ўтварэння слабых электралітаў.
Аніёны слабых кіслот, узаемадзейнічаючы з катыёнамі вадароду, могуць утвараць слаба дысацыіраваныя малекулы кіслаты. Катыёны слабых асноў, узаемадзейнічаючы з гідраксід-іонамі, могуць утвараць маладысацыіраваныя асновы.
Асяроддзе ў водных растворах солей, якія гідралізуюцца, можа быць кіслым (pH < 7,0) або шчолачным (pH > 7,0) таму, што ў растворы солі ў выніку гідролізу з’яўляецца лішак іонаў Н+ або ОН–.
Адрозненне асяроддзя раствору солі ад нейтральнага — адна з прыкмет гідролізу солі. Наколькі вялікае гэтае адрозненне, а таксама кіслым або шчолачным з’яўляецца раствор солі, залежыць ад сілы асновы і кіслаты, з якіх гэтая соль утвараецца па рэакцыі нейтралізацыі.
Класіфікацыя солей па іх схільнасці да рэакцыі гідролізу
Любая соль можа быць прадстаўлена як прадукт рэакцыі нейтралізацыі (ад лац. neuter — ні той, ні іншы) пры ўзаемадзеянні кіслаты і асновы. Кіслоты і асновы могуць быць як моцнымі, так і слабымі электралітамі.
Рэакцыя нейтралізацыі — гэта рэакцыя абмену паміж кіслатой і асновай з утварэннем солі і вады:
KOH + HF = KF + H2O.
Кіслоты і асновы як электраліты адрозніваюцца па сваёй сіле. Напрыклад, солі амонію можна разглядаць як утвораныя ў рэакцыі з удзелам слабай асновы — гідрату аміяку NH3 · H2O. Соль KF утворана моцнай асновай KОН і слабай кіслатой HF, сульфід амонію — слабай асновай і слабай кіслатой.
У залежнасці ад сілы асновы і кіслаты можна вылучыць чатыры тыпы солей (мал. 60.1).
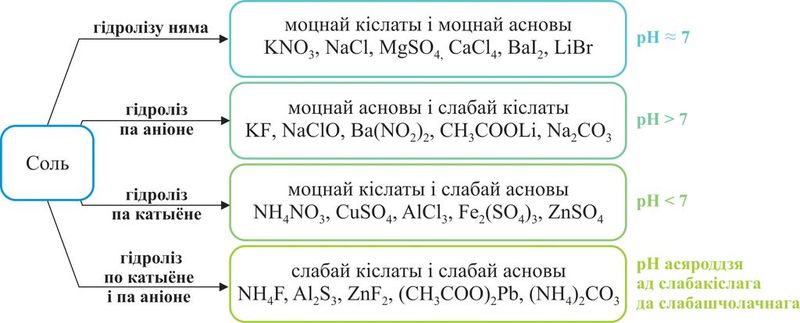
Разгледзім гідроліз солей усіх чатырох тыпаў.
Солі, утвораныя моцнай асновай і слабай кіслатой. У якасці прыкладу можна прывесці ацэтат натрыю CH3COONa. Гэтая соль утворана моцнай асновай NaОН і слабай кіслатой CH3COOH:
NaОН + CH3COOH = CH3COONa + H2O.
У водным растворы ацэтату натрыю працякаюць два працэсы:
а) поўная дысацыяцыя моцнага электраліту — солі CH3COONa на катыён і аніён:
CH3COONa → Na+ + CH3COO–;
б) узаемадзеянне ацэтат-іонаў з малекуламі вады з утварэннем слабага электраліту — воцатнай кіслаты:
CH3COO– + H2О CH3COOH + ОН–.
Лішак аніёнаў ОН– назапашваецца ў растворы і стварае слабашчолачнае асяроддзе, што сведчыць аб працяканні гідролізу па аніёне CH3COO–.
Ураўненне гідролізу ацэтату натрыю паказвае, што:
- а) у растворы канцэнтрацыя гідраксід-аніёнаў большая, чым у чыстай вадзе, таму раствор СH3COONa мае слабашчолачнае асяроддзе (pH > 7);
- б) у рэакцыі абмену з вадой і ва ўтварэнні слабай кіслаты ўдзельнічаюць толькі аніёны СH3COO–, таму гавораць, што гідроліз ідзе па аніёне.
Раўнавага гідролізу ў дадзеным прыкладзе моцна зрушана ўлева — у бок утварэння зыходных рэчываў, бо вада — значна больш слабы электраліт, чым воцатная кіслата СH3COOH.
Гідроліз з’яўляецца рэакцыяй, адваротнай нейтралізацыі.
Прыклады аніёнаў слабых кіслот, солі якіх гідралізуюцца вадой:
- а) аніёны слабых аднаасноўных кіслот: HCOO–,
, F–;
- б) аніёны слабых шматасноўных кіслот: S2–,
,
,
,
.
Разгледзім гідроліз карбанату натрыю Na2СO3 — солі моцнай асновы NaOH і слабай двухасноўнай кіслаты H2CO3. Гідроліз працякае па аніёне у адпаведнасці з ураўненнем у поўнай іоннай форме:
2Na+ + + H2O
2Na+ +
+ OH–.
Ураўненне ў скарочанай іоннай форме выглядае так:
+ H2O
+ OH–.
У растворы Na2СO3 утвараецца лішак гідраксід-аніёнаў і ствараецца шчолачнае асяроддзе. Раствор Na2CO3 з канцэнтрацыяй 0,1 моль/дм3 мае рН каля 11,5.
Солі, утвораныя моцнай кіслатой і слабай асновай. Разгледзім гідроліз хларыду амонію NH4Cl. Гэта соль моцнай кіслаты — HCl і слабай асновы — гідрату аміяку NH3 · H2O.
У водным растворы солі працякаюць два працэсы:
а) поўная дысацыяцыя моцнага электраліту — солі NH4Cl:
NH4Cl → + Cl–;
б) узаемадзеянне іонаў амонію з малекуламі вады з утварэннем слабага электраліту — гідрату аміяку NH3 · H2O:
+ H2O
NH3 · H2O + H+.
Гэтае ўраўненне паказвае, што:
- а) у растворы назапшаюцца катыёны вадароду Н+ і іх канцэнтрацыя становіцца большай, чым у чыстай вадзе, таму раствор NH4Cl мае кіслае асяроддзе (pH < 7);
- б) у рэакцыі абмену з вадой з утварэннем слабай асновы ўдзельнічаюць толькі катыёны амонію
, таму кажуць, што ідзе гідроліз па катыёне.
У рэакцыю з вадой могуць уступаць і шматзарадныя катыёны: двухзарадныяNi2+, Cu2+, Zn2+, Mn2+, Fe2+, Co2+, Pb2+ (акрамя катыёнаў Mg2+, Ca2+, Sr2+, Ba2+), трохзарадныя Fe3+, Al3+, Сr3+.
Разгледзім гідроліз нітрату медзі(II) Сu(NO3)2. Гэта соль моцнай кіслаты — HNO3 і слабай асновы — Cu(OH)2.
У гэтым выпадку прынята гаварыць, што гідроліз солі адбываецца па катыёне Cu2+. Ураўненне гідролізу ў поўнай іоннай форме:
Cu2+ + + H2O
Cu(OH)+ +
+ H+.
Ураўненне гідролізу ў скарочанай іоннай форме:
Cu2+ + H2O Cu(OH)+ + H+.
Прадуктамі гідролізу з’яўляюцца асноўная соль Cu(OH)NO3 і азотная кіслата HNO3.
Асяроддзе воднага раствору нітрату медзі(II) кіслае (pH ≈ 4,5), паколькі ў растворы ёсць лішак катыёнаў Н+.
Солі, утвораныя слабай асновай і слабай кіслатой. Такія солі падвяргаюцца гідролізу і па катыёне, і па аніёне. Пры гэтым іоны Н+, якія з’яўляюцца пры гідролізе па катыёне, звязваюцца ўтворанымі пры гідролізе па аніёне іонамі ОН–, што ўзмацняе гідроліз. Нярэдка гэтая рэакцыя неабарачальная. Напрыклад, сульфід алюмінію Al2S3 у вадзе падвяргаецца неабарачальнаму гідролізу з утварэннем нерастваральнага гідраксіду алюмінію і газападобнага серавадароду:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑.
Таму сульфід алюмінію Al2S3 нельга атрымаць рэакцыяй абмену паміж воднымі растворамі дзвюх солей, напрыклад нітрату алюмінію Al(NO3)3 і сульфіду калію K2S.
Магчымыя і іншыя выпадкі незваротнага гідролізу. Іх няцяжка прадказаць, бо для незваротнасці працэсу неабходна, каб прынамсі адзін з прадуктаў гідролізу сыходзіў са сферы рэакцыі. Прывядзём прыклад сумеснага неабарачальнага гідролізу катыёнаў Al3+ і аніёнаў :
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaNO3 + 3CO2↑.
Для солей, якія падвяргаюцца неабарачальнаму гідролізу, у табліцы «Растваральнасць кіслот, асноў і солей у вадзе» вы знойдзеце заўвагу: «не існуюць у водным растворы».
Падвядзём вынік таму, што вы даведаліся пра гідроліз і па катыёне, і па аніёне:
- а) калі солі гідралізуюцца па катыёне і аніёне адначасова, то раўнавага ў гэтай рэакцыі больш зрушана ўправа, чым для гідролізу гэтых іонаў паасобку;
- б) становішча раўнавагі рэакцыі гідролізу па катыёне і аніёне не залежыць ад канцэнтрацыі солі (дакажыце гэта самастойна);
- в) рэакцыя асяроддзя пры гэтым відзе гідролізу можа быць нейтральнай, слабакіслай або слабашчолачнай, што залежыць ад сілы ўтвораных асновы і кіслаты (слабакіслае асяроддзе сведчыць, што аснова з’яўляецца больш слабым электралітам, чым кіслата, а слабашчолачнае асяроддзе — наадварот);
- г) солі могуць неабарачальна гідралізавацца па катыёне і аніёне пры ўмове, што прынамсі адзін з прадуктаў гідролізу сыходзіць са сферы рэакцыі.
Абагульнім інфармацыю пра гідроліз сярэдніх солей па катыёнам і аніёнам у табліцы 19.1.
Табліца 19.1. Параўнанне солей па гідралізуемасці
| Гідралізавальнасць | Не схільныя да гідролізу | Схільныя да слабага гідролізу і пералічаныя ў парадку яго ўзмацнення | Схільныя да моцнага гідролізу і пералічаныя ў парадку яго ўзмацнення |
| Катыёны | K+, Na+, Li+, Ba2+, Sr2+, Ca2+, Mg2+, Ag+ | Mn2+, Co2+, Zn2+, Ni2+, Fe2+, Pb2+, Cu2+, Be2+ | Al3+, Cr3+, Sn2+, Fe3+ |
| Аніёны | Cl–, Br–, I–, |
F–, |
Не гідралізуюцца: растваральныя галагеніды (акрамя фтарыдаў), нітраты, перхлараты, сульфаты і перманганаты шчолачных і шчолачназямельных металаў.
Адзначым, што рэакцыі абарачальнага гідролізу падпарадкоўваюцца прынцыпу Ле Шатэлье, таму гідроліз солі можна як узмацніць, так і аслабіць.
Гідроліз солей абумоўлены працяканнем рэакцый іоннага абмену з удзелам малекул вады і іонаў солі з утварэннем слабага электраліту.
Гідроліз па аніёне, як правіла, абарачальны і працякае ў невялікай ступені. Пры разбаўленні раствораў солей раўнавага гідролізу зрушваецца ўправа, рэакцыя асяроддзя ў растворах солей слабых кіслот слабашчолачная, зрэдку моцнашчолачная.
Гідроліз па катыёне, як правіла, абарачальны і працякае ў невялікай ступені. Пры развядзенні раствораў солей раўнавага гідролізу зрушваецца ўправа, рэакцыя асяроддзя ў растворах солей слабых асноў слабакіслая, зрэдку моцнакіслая.
Гідроліз адначасова па катыёне і аніёне працякае ў значна большай ступені, чым гідроліз гэтых іонаў паасобку. Становішча раўнавагі рэакцыі гідролізу па катыёне і аніёне не залежыць ад канцэнтрацыі солі, а рэакцыя асяроддзя раствору не моцна адхіляецца ад нейтральнай.
Солі слабых кіслот і асноў незваротна гідралізуюцца па катыёне і аніёне пры выдаленні з раствору аднаго з прадуктаў рэакцыі ў выглядзе газу.
Пытанні, заданні, задачы
1. Солі якіх тыпаў схільныя да гідролізу?
2. Якія з солей, формулы якіх: K3PO4, Al2(SO4)3, MgSO4, NH4NO3, Pb(NO3)2, Na2CO3, падвяргаюцца гідролізу па катыёне? Складзіце ўраўненні гідролізу гэтых солей, укажыце рэакцыю асяроддзя.
3. Якія з солей, формулы якіх: Na2S, AlCl3, K2SO3, Cr2(SO4)3, (CH3COO)2Ba, AgF, Mg(NO3)2, Na2SiO3, KMnO4, Na3PO4, падвяргаюцца гідролізу па аніёне? Складзіце ўраўненні гідролізу гэтых солей, укажыце рэакцыю асяроддзя і афарбоўку лакмусу ў растворы.
4. Рэакцыя нейтралізацыі моцных кіслот або асноў працякае з вылучэннем цеплаты. Выкарыстоўваючы прынцып Ле Шатэлье, абгрунтуйце, чаму пры награванні раўнавага гідролізу зрушваецца ўправа.
5. Ступень дысацыяцыі вады ўзрастае ў 7,5 разоў пры яе награванні ад 25 °С да 100 °С і памяншаецца ў 3 разы пры астуджэнні вады ад 25 °С да 0 °С. Дайце тлумачэнне гэтым фактам з улікам таго, што дысацыяцыя вады — эндатэрмічная рэакцыя. Куды зрушваецца раўнавага гідролізу пры павышэнні і паніжэнні тэмпературы і як яна залежыць ад ступені дысацыяцыі вады?
6. Якія з прыведзеных солей падвяргаюцца гідролізу і па катыёне, і па аніёне: NH4F, (CH3COO)3Al, (CH3COO)2Cu, (NH4)2CO3, KNO2, AgNO3, Na3PO4, CrCl3? Складзіце ўраўненні гідролізу гэтых солей (усе рэакцыі абарачальныя) у поўнай іоннай форме.
7. Дадаванне якіх з названых рэчываў да раствору сульфату жалеза(III) узмоцніць гідроліз солі: НСl, NH3, HNO3, Н2O, K2CO3? Дайце тлумачэнне.
8. Стэарат натрыю C17H35COONа (цвёрдае мыла) гідралізуецца ў вадзе па аніёне. Састаўце ўраўненне гідролізу ў поўнай і скарочанай іоннай формах і ўкажыце, якое асяроддзе мае раствор. Як уплываюць тэмпература і разбаўленне раствору мыла на раўнавагу рэакцыі гідролізу? Чаму сода Na2CO3 перашкаджае гідролізу мыла?
9. Ачыстка пітной вады ад узважаных нерастваральных прысей праводзіцца метадам каагуляцыі — зліпання дробных часціц з утварэннем больш буйных шматкоў, якія выпадаюць у асадак. Каагуляцыя ўключае тры стадыі: змешванне рэагентаў з ачышчанай вадой, утварэнне шматкоў і асаджэнне шматкоў разам з забруджвальнікам. Для правядзення каагуляцыі ваду падшчалочваюць содай і дадаюць растваральную соль алюмінію. У вадзе соль алюмінію ператвараецца ў Al(OH)3 па схеме адначасовага гідролізу па катыёне Al3+ і аніёне . Утвораны Al(OH)3 уяўляе сабой белыя шматкі з вялікай паверхняй. Шматкі захопліваюць узважаныя часціцы, бактэрыі, іоны цяжкіх металаў, потым узбуйняюцца і асядаюць разам з забруджваннямі на дно адстойніка. Напішыце ўраўненне рэакцыі паміж сульфатам алюмінію і карбанатам натрыю ў малекулярнай, поўнай і скарочанай іоннай формах.
10. Пры зліванні раствораў FeCl3 і Na2CO3 выпадае асадак бурага колеру і назіраецца вылучэнне газу. Якое рэчыва выпадае ў асадак і які газ вылучаецца? Напішыце ўраўненне рэакцыі, якая працякае, і разлічыце аб’ём (н. у.) вылучанага газу, калі да раствору Na2CO3 аб’ёмам 100 см3 з масавай доляй растворанага рэчыва 7,85 % і шчыльнасцю 1,080 г/см3 прылілі лішак раствору FeCl3.
Самакантроль
1. Шчолачнае асяроддзе маюць растворы солей:
- а) ВаCl2 і MgCl2;
- б) K2SO3 і KNO2;
- в) С6Н5ОNa і С17Н35СООNa;
- г) K2СO3 і K2S.
2. рН > 7 маюць водныя растворы:
- а) Na2СO3;
- б) FeCl3;
- в) CH3COONа;
- г) CuSO4.
3. Лакмус афарбуе ў чырвоны колер раствор:
- а) Pb(NO3)2;
- б) ZnCl2;
- в) KCl;
- г) NH4Cl.
4. Раўнавагу рэакцыі гідролізу ў растворы меднага купарвасу
Cu2+ + H2O Cu(OH)+ + H+
можна зрушыць улева («падавіць гідроліз»):
- а) развёўшы вадой;
- б) астудзіўшы раствор;
- в) дадаўшы раствор соды;
- г) дадаўшы сернай кіслаты.
5. Не ўтвараецца соль пры зліванні раствораў:
- а) FeCl3 і Na2CO3;
- б) AlCl3 і K2CO3;
- в) BaCl2 і Na2CO3;
- г) NH4Cl і AgNO3.