§ 26. Паняцце аб вадародным паказчыку (рН) раствору
Вада з’яўляецца слабым электралітам і толькі ў невялікай ступені дысацыіруе на іоны Н+ і ОН–:
Пры 25 °С ступень дысацыяцыі α вады роўная прыкладна 2 ∙ 10–9. Гэта азначае, што з мільярда малекул вады толькі дзве малекулы знаходзяцца ў выглядзе іонаў Н+ і ОН–.
Канцэнтрацыя іонаў вадароду с(Н+) роўная 10–7 моль/дм3. Такая ж канцэнтрацыя гідраксільных груп с(ОН–).
Здабытак канцэнтрацый іонаў Н+ і OH– у вадзе і водных растворах з’яўляецца велічынёй пастаяннай пры пэўнай тэмпературы. Так, пры 25 °C:
Растворы, у якіх канцэнтрацыя катыёнаў вадароду роўная канцэнтрацыі гідраксід-аніёнаў, называюць нейтральнымі. Калі канцэнтрацыя катыёнаў вадароду ў растворы большая за канцэнтрацыю гідраксід-аніёнаў, гэта значыць c(Н+) > c(ОН–), то асяроддзе раствору кіслае. Калі ж у растворы пераважаюць гідракід-аніёны, гэта значыць c(ОН–) > c(Н+), то асяроддзе раствору шчолачнае.
Колькасна кіслотнасць і звязаную з ёй асноўнасць (шчолачнасць) асяроддзя раствораў выражаюць з дапамогай вадароднага паказчыка рH (чытаецца «пэ-аш»). Вадародны паказчык уяўляе сабой дзесятковы лагарыфм канцэнтрацыі іонаў вадароду ў растворы, узяты са знакам «мінус»:
рH = –lgc(H+).
Вадародны паказчык pH — гэта мера канцэнтрацыі ў растворы катыёнаў вадароду H+, якая колькасна выражае кіслотнасць раствору.
Вадародны паказчык з’яўляецца безразмернай велічынёй.
Напрыклад, пры малярнай канцэнтрацыі катыёнаў H+ c(H+) = 10–5 моль/дм3 рН роўны 5, а пры c(H+) = 10–3 моль/дм3 рН роўны 3.
Прыклад 1. Вызначце рН раствору сернай кіслаты, малярная канцэнтрацыя якой роўная 0,005 моль/дм3.
Дадзена:
с(H2SO4) = 0,005 моль/дм3
pH — ?
Рашэнне
Няхай V(р-ру) = 1 дм3.
Тады
n(H2SO4) = 0,005 моль/дм3 · 1 дм3 = 0,005 моль.
Вызначым колькасць іонаў вадароду па ўраўненні дысацыяцыі кіслаты:
, адкуль х = 0,01 моль, значыць n(Н+) = 0,01 моль.
Малярная канцэнтрацыя іонаў вадароду роўная:
Разлічым вадародны паказчык:
рН = –lgс(Н+) = –lg10–2 = 2.
Адказ: рН = 2.
Разлічым вадародны паказчык у шчолачным растворы.
Прыклад 2. Вызначце pH раствору NaOH с малярнай канцэнтрацыяй 0,01 моль/дм3.
Дадзена:
с(NaOH) = 0,01 моль/дм3
pH — ?
Рашэнне
Канцэнтрацыя аніёнаў OH– у такім растворы роўная 10–2 моль/дм3. Разлічым канцэнтрацыю іонаў вадароду, ведаючы, што с(Н+) ∙ с(ОН)– = 10–14.
, адкуль
значыць,
рН = –lgc(H+) = –lg10–12 = 12 (шчолачнае асяроддзе).
Адказ: рН = 12.
Звярніце ўвагу на тое, што і ў шчолачным асяроддзі катыёны H+ працягваюць прысутнічаць у водным растворы.
Паколькі ў вадзе пры 20–25 °С канцэнтрацыі іонаў H+ і OH– аднолькавыя і роўныя 10–7 моль/дм3, то для чыстай вады рН = –lgc(H+) = –lg10–7 = 7. Такое значэнне рН адпавядае нейтральнаму асяроддзю. Значэнню рН < 7 адпавядае большая кіслотнасць раствору, а рН > 7 адпавядае большая шчолачнасць раствору (мал. 59).
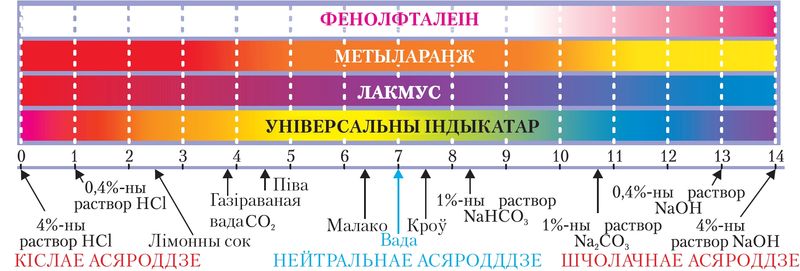
Такім чынам, значэнне рН можна разлічыць, а таксама ацаніць з дапамогай асобных індыкатараў (лакмусу, фенолфталеіну, метыларанжу), універсальнага індыкатара са шкалой рН і прыбораў — рН-метраў (мал. 59, 60).

Вымярэнне рН неабходнае ў медыцыне, сельскай гаспадарцы, навуцы, на вытворчасці. У арганізме здаровага чалавека рН крыві складае 7,4, страўнікавага соку — 1,7, сліны — 6,9, слёз — 7,3–7,5. Пры кансерваванні дабаўленне воцатнай кіслаты ў марынад да pH < 4,5 падаўляе дзейнасць большасці бактэрый. З аналагічнай мэтай у састаў прахаладжальных напояў уводзяць лімонную кіслату для паніжэння значэння рН да 3. Для нармальнага развіцця раслін часцей за ўсё неабходна памяншаць кіслотнасць глеб вапнаваннем з дапамогай мелу CaCO3, даламітавай мукі CaMg(CO3)2 ці некаторых угнаенняў да рН = 6,0–6,5 (табл. 16).
Табліца 16. Класіфікацыя дыяпазонаў рН глебы
| Кіслотнасць глебы | Дыяпазон рН |
| Кіслая | 3,5–6,0 |
| Нейтральная і блізкая да нейтральнай | 6,1–7,8 |
| Шчолачная | 7,9–9,0 и выше |