§ 26. Паняцце аб вадародным паказчыку (рН) раствору
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 26. Паняцце аб вадародным паказчыку (рН) раствору |
| Напечатано:: | Гость |
| Дата: | Пятница, 30 Май 2025, 11:53 |
Вада з’яўляецца слабым электралітам і толькі ў невялікай ступені дысацыіруе на іоны Н+ і ОН–:
Пры 25 °С ступень дысацыяцыі α вады роўная прыкладна 2 ∙ 10–9. Гэта азначае, што з мільярда малекул вады толькі дзве малекулы знаходзяцца ў выглядзе іонаў Н+ і ОН–.
Канцэнтрацыя іонаў вадароду с(Н+) роўная 10–7 моль/дм3. Такая ж канцэнтрацыя гідраксільных груп с(ОН–).
Здабытак канцэнтрацый іонаў Н+ і OH– у вадзе і водных растворах з’яўляецца велічынёй пастаяннай пры пэўнай тэмпературы. Так, пры 25 °C:
Растворы, у якіх канцэнтрацыя катыёнаў вадароду роўная канцэнтрацыі гідраксід-аніёнаў, называюць нейтральнымі. Калі канцэнтрацыя катыёнаў вадароду ў растворы большая за канцэнтрацыю гідраксід-аніёнаў, гэта значыць c(Н+) > c(ОН–), то асяроддзе раствору кіслае. Калі ж у растворы пераважаюць гідракід-аніёны, гэта значыць c(ОН–) > c(Н+), то асяроддзе раствору шчолачнае.
Колькасна кіслотнасць і звязаную з ёй асноўнасць (шчолачнасць) асяроддзя раствораў выражаюць з дапамогай вадароднага паказчыка рH (чытаецца «пэ-аш»). Вадародны паказчык уяўляе сабой дзесятковы лагарыфм канцэнтрацыі іонаў вадароду ў растворы, узяты са знакам «мінус»:
рH = –lgc(H+).
Вадародны паказчык pH — гэта мера канцэнтрацыі ў растворы катыёнаў вадароду H+, якая колькасна выражае кіслотнасць раствору.
Вадародны паказчык з’яўляецца безразмернай велічынёй.
Напрыклад, пры малярнай канцэнтрацыі катыёнаў H+ c(H+) = 10–5 моль/дм3 рН роўны 5, а пры c(H+) = 10–3 моль/дм3 рН роўны 3.
Прыклад 1. Вызначце рН раствору сернай кіслаты, малярная канцэнтрацыя якой роўная 0,005 моль/дм3.
Дадзена:
с(H2SO4) = 0,005 моль/дм3
pH — ?
Рашэнне
Няхай V(р-ру) = 1 дм3.
Тады
n(H2SO4) = 0,005 моль/дм3 · 1 дм3 = 0,005 моль.
Вызначым колькасць іонаў вадароду па ўраўненні дысацыяцыі кіслаты:
, адкуль х = 0,01 моль, значыць n(Н+) = 0,01 моль.
Малярная канцэнтрацыя іонаў вадароду роўная:
Разлічым вадародны паказчык:
рН = –lgс(Н+) = –lg10–2 = 2.
Адказ: рН = 2.
Разлічым вадародны паказчык у шчолачным растворы.
Прыклад 2. Вызначце pH раствору NaOH с малярнай канцэнтрацыяй 0,01 моль/дм3.
Дадзена:
с(NaOH) = 0,01 моль/дм3
pH — ?
Рашэнне
Канцэнтрацыя аніёнаў OH– у такім растворы роўная 10–2 моль/дм3. Разлічым канцэнтрацыю іонаў вадароду, ведаючы, што с(Н+) ∙ с(ОН)– = 10–14.
, адкуль
значыць,
рН = –lgc(H+) = –lg10–12 = 12 (шчолачнае асяроддзе).
Адказ: рН = 12.
Звярніце ўвагу на тое, што і ў шчолачным асяроддзі катыёны H+ працягваюць прысутнічаць у водным растворы.
Паколькі ў вадзе пры 20–25 °С канцэнтрацыі іонаў H+ і OH– аднолькавыя і роўныя 10–7 моль/дм3, то для чыстай вады рН = –lgc(H+) = –lg10–7 = 7. Такое значэнне рН адпавядае нейтральнаму асяроддзю. Значэнню рН < 7 адпавядае большая кіслотнасць раствору, а рН > 7 адпавядае большая шчолачнасць раствору (мал. 59).
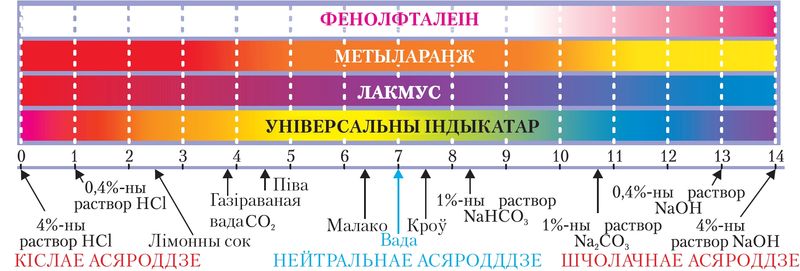
Такім чынам, значэнне рН можна разлічыць, а таксама ацаніць з дапамогай асобных індыкатараў (лакмусу, фенолфталеіну, метыларанжу), універсальнага індыкатара са шкалой рН і прыбораў — рН-метраў (мал. 59, 60).

Вымярэнне рН неабходнае ў медыцыне, сельскай гаспадарцы, навуцы, на вытворчасці. У арганізме здаровага чалавека рН крыві складае 7,4, страўнікавага соку — 1,7, сліны — 6,9, слёз — 7,3–7,5. Пры кансерваванні дабаўленне воцатнай кіслаты ў марынад да pH < 4,5 падаўляе дзейнасць большасці бактэрый. З аналагічнай мэтай у састаў прахаладжальных напояў уводзяць лімонную кіслату для паніжэння значэння рН да 3. Для нармальнага развіцця раслін часцей за ўсё неабходна памяншаць кіслотнасць глеб вапнаваннем з дапамогай мелу CaCO3, даламітавай мукі CaMg(CO3)2 ці некаторых угнаенняў да рН = 6,0–6,5 (табл. 16).
Табліца 16. Класіфікацыя дыяпазонаў рН глебы
| Кіслотнасць глебы | Дыяпазон рН |
| Кіслая | 3,5–6,0 |
| Нейтральная і блізкая да нейтральнай | 6,1–7,8 |
| Шчолачная | 7,9–9,0 и выше |
*Дысацыяцыя вады
Абарачальная рэакцыя дысацыяцыі вады падпарадкоўваецца прынцыпу Ле Шатэлье, а канцэнтрацыі іонаў Н+ і ОН– у водных растворах узаемазвязаныя. Напрыклад, павелічэнне канцэнтрацыі катыёнаў Н+ удвая выклікае зрушэнне раўнавагі налева і памяншэнне ў 2 разы канцэнтрацыі аніёнаў ОН–. Наадварот, павелічэнне канцэнтрацыі аніёнаў OH– прыводзіць да прапарцыйнага памяншэння канцэнтрацыі катыёнаў Н+.
Дысацыяцыя вады з’яўляецца моцна эндатэрмічнай рэакцыяй і працякае з паглынаннем цеплаты ў колькасці 57 кДж/моль. Пры 10 °С ступень дысацыяцыі вады α роўная прыкладна 1 · 10–9, а пры 100 °С — 1,4 · 10–8. Такая залежнасць α ад тэмпературы — вынік зрушэння раўнавагі эндатэрмічнай рэакцыі дысацыяцыі ўправа пры павышэнні тэмпературы.
Здабытак канцэнтрацый іонаў Н+ і OH– у вадзе і водных растворах носіць назву іонны здабытак вады і пазначаецца Kw. Пры 25 °С яго велічыня складае:
Kw = c(H+) · c(OH−) = 10−14 (моль/дм3)2.
Іонны здабытак вады Kw — гэта здабытак канцэнтрацый катыёнаў вадароду Н+ і гідраксід-аніёнаў OH− у вадзе ці ў водных растворах. Пры зададзенай тэмпературы Kw з’яўляецца пастаяннай велічынёй не толькі для чыстай вады, але таксама і для разбаўленых водных раствораў рэчываў.
Паняцце вадародны паказчык было ўведзена ў 1909 годзе дацкім хімікам С. П. Л. Серэнсенам. У сімвале рН (ад лац. pondus Hydrogenii — «колькасць вадароду») p — гэта пачатковая літара слова pondus або potenz (ням.) — «сіла». У цяперашні час літара p страціла першапачатковае значэнне скарачэння слова і цяпер у хіміі з’яўляецца сімвалам, які замяняе аперацыю –lg, а літара Н паранейшаму паказвае на канцэнтрацыю катыёна вадароду c(H+).
*Кіслотнасць і шчолачнасць асяроддзя
Інтэрвал рН ад 4 да 7 адпавядае слабакісламу асяроддзю, а інтэрвал ад 7 да 10 — слабашчолачнаму. Значэнні рН < 4 адпавядаюць моцнакісламу асяроддзю, а рН > 10 — слабашчолачнаму (табл. 15.2).
У шчолачных растворах рН вызначаецца з выкарыстаннем колькаснага значэння Kw = [H+] · [OH–] = c(H+) · c(OH−) = 10−14 (моль/дм3)2 пры 25 °C.
Табліца 15.2. Афарбоўка ўніверсальнай індыкатарнай паперы і рН у растворах HCl і NaOH розных канцэнтрацый
| ω(HCl), % | c(H+), моль/дм3 | рН | Афарбоўка ўніверсальнага індыкатару | рН | c(OH–), моль/дм3 | ω(NaOH), % | ||
| 4 | 1 | 0 | ↑ Кіслотнасць асяроддзя |
0 | 10–14 | – | ||
| 0,4 | 10–1 | 1 | 1 | 10–13 | – | |||
| 0,04 | 10–2 | 2 | 2 | 10–12 | – | |||
| 0,004 | 10–3 | 3 | 3 | 10–11 | – | |||
| 0,0004 | 10–4 | 4 | 4 | 10–10 | – | |||
| 0,00004 | 10–5 | 5 | 5 | 10–9 | – | |||
| 0,000004 | 10–6 | 6 | 6 | 10–8 | – | |||
| Вада | 10–7 | 7 | 7 | 10–7 | Вада | |||
| – | 10–8 | 8 | Шчолачнасць асяроддзя ↓ |
8 | 10–6 | 0,000004 | ||
| – | 10–9 | 9 | 9 | 10–5 | 0,00004 | |||
| – | 10–10 | 10 | 10 | 10–4 | 0,0004 | |||
| – | 10–11 | 11 | 11 | 10–3 | 0,004 | |||
| – | 10–12 | 12 | 12 | 10–2 | 0,04 | |||
| – | 10–13 | 13 | 13 | 10–1 | 0,4 | |||
| – | 10–14 | 14 | 14 | 1 | 4 | |||
рН набліжана вымераюць з дапамогай універсальнай індыкатарнай паперы, афарбоўка якой пасля змочвання ў доследным растворы параўноўваецца са спецыяльнай рН-шкалой, прыведзенай у табліцы 15.2.
*Уплыў рН на біяхімічныя працэсы
На малочных камбінатах свежасць малака вызначаюць па велічыні рН. У свежым малацэ рН = 6,7, гэта значыць малако мае практычна нейтральнае асяроддзе.
У неахалоджаным малацэ кіслотнасць хутка павялічваецца за кошт размнажэння малочнакіслых бактэрый, якія зброджваюць малочны цукар (лактозу) у малочную кіслату. Малочная кіслата згортвае асноўны бялок малака — казеін. Калі малако не астудзіць або доўга захоўваць, то па меры назапашвання малочнай кіслаты яно згусне пры кіпячэнні або так моцна скісне, што згусне нават без награвання.
Ад велічыні рН залежаць шматлікія хімічныя і біялагічныя працэсы. Большасць з іх працякае з неабходнай скорасцю і ў патрэбным кірунку толькі пры пэўнай кіслотнасці асяроддзя. Тканкі арганізма чалавека вельмі адчувальныя да ваганняў паказчыка pH: за межамі дапушчальнага дыяпазону 7,34–7,45 магчымыя разбурэнне клетак, страта здольнасці выконваць свае функцыі бялкамі-каталізатарамі (ферментамі), што вядзе да гібелі арганізма. Таму кіслотна-шчолачны баланс у здаровым арганізме жорстка рэгулюецца. Адхіленне ад нармальнай фізіялагічнай велічыні рН крыві (рН = 7,4), страўнікавага соку (1,5–2,0), мачы (6,0), скуры (4,7–5,5), сакрэту падстраўнікавай залозы (8,1), спіннамазгавой вадкасці (7,5), сліны (6,2–7,4), слёз (7,3–7,5) і іншага з’яўляецца сімптомам шэрагу захворванняў.
Квашанне як нарыхтоўка гародніны ў запас заснавана на малочнакіслым закісанні, у працэсе якога ўтвараецца малочная кіслата, якая аказвае на прадукты кансервавальнае дзеянне.
Зубны налёт з мікраарганізмаў, якія вылучаюць малочную кіслату, стварае мясцовае кіслае асяроддзе, што прыводзіць да разбурэння зубоў у выніку растварэння крышталёў гідроксіапатыту Ca10(PO4)6(OH)2 зубной эмалі пры рН < 4,5.
Вадародны паказчык pH — гэта мера канцэнтрацыі катыёнаў вадароду H+ у растворы. Разлічваюць вадародны паказчык па формуле рН = –lgc(H+).
Пытанні, заданні, задачы
1. Пакажыце кіслотнасць асяроддзя (кіслае, нейтральнае, шчолачнае), а таксама адпаведную афарбоўку ўніверсальнага індыкатару:
- а) рН = 14;
- б) рН = 4;
- в) рН = 6;
- г) рН = 9.
2. Больш ці менш за сем будзе рН раствору пасля зліцця роўных аб’ёмаў раствораў гідраксіду калію і сернай кіслаты, якія маюць малярную канцэнтрацыю 0,1 моль/дм3?
3. Складзіце ўраўненні дысацыяцыі рэчываў, у растворах якіх лакмус набывае чырвоную афарбоўку: LiОН, HCOOH, HNO3, Ca(OH)2, HCl, H2SO4.
4. Дадзены растворы злучэнняў: NaOH, HCl, NaCl, KOH, HNO3, Ca(OH)2, NH3, CO2, SO2, СH3СOOH, HNO2, HF. Пры ўмове аднолькавай малярнай канцэнтрацыі якія з раствораў маюць нейтральнае асяроддзе, pH > 7, pH < 7?
5. Разлічыце значэнне рН у растворы:
- а) бромавадароднай кіслаты з малярнай канцэнтрацыяй 0,0001 моль/дм3;
- б) сернай кіслаты з малярнай канцэнтрацыяй 0,05 моль/дм3.
6. Вызначце pH раствору KOH c малярнай канцэнтрацыяй 0,001 моль/дм3.
7. Зыходзячы са значэння здабытку c(H+) · c(OH−) = 10−14 (моль/дм3)2 пры 25 °C, знайдзіце значэнне малярнай канцэнтрацыі c(OH–) пры рН 2, 5, 8, 12 і 14. Як прыгатаваць растворы з рН = 2 і рН = 14?
8. Чаму роўная малярная канцэнтрацыя (моль/дм3) іонаў вадароду ў растворы з рН = 4?
9. Якое асяроддзе будзе ў растворы, атрыманым пры змешванні роўных аб’ёмаў раствораў, што ўтрымліваюць 3 моль гідраксіду натрыю і 2 моль сернай кіслаты?
10. У растворы азотнай кіслаты лік малекул, якія не прадысацыіравалі, у 2,5 раза большы за лік малекул, якія прадысацыіравалі. Пакажыце ступень дысацыяцыі α (у працэнтах) і рН раствору, калі зыходная канцэнтрацыя кіслаты ў ім была роўная 0,0035 моль/дм3.
*Пытанні, заданні, задачы
1. Чаму вада з’яўляецца слабым электралітам?
2. Чаму ступень дысацыяцыі вады павялічваецца пры награванні?
3. Што такое іонны здабытак вады?
4. Якія хімічныя ўласцівасці раствораў характарызуе вадародны паказчык рН?
5. Большы ці меншы за 7 будзе рН раствору пасля злівання роўных аб’ёмаў раствораў гідраксіду калію і сернай кіслаты, якія маюць малярную канцэнтрацыю 0,1 моль/дм3?
6. Як зменіцца канцэнтрацыя катыёнаў H+ у водным растворы пры павелічэнні ў ім канцэнтрацыі аніёнаў OH– у 3 разы?
7. Знайдзіце значэнне малярнай канцэнтрацыі c(OH−) пры рН 0, 4, 7, 11 і 14.
9. Пры 10 °С ступень дысацыяцыі вады α роўная 9,7 · 10–10 (ρ10вады = 0,9997 г/см3), а пры 100 °С — 1,39 · 10–8 (ρ100вады = 0,9584 г/см3). Разлічыце Кw для гэтых тэмператур.
10. У растворы азоцістай кіслаты лік непрадысацыіраваных малекул у 2,5 разы большы за лік прадысацыіраваных. Укажыце ступень дысацыяцыі α (у працэнтах) і рН раствору, калі зыходная канцэнтрацыя кіслаты ў ім была роўная 0,0035 моль/дм3.
*Самакантроль
1. Укажыце несправядлівыя сцвярджэнні:
- а) у растворы кіслаты адсутнічаюць іоны ОН–;
- б) рН вымяраецца ў моль/дм3;
- в) чым большая канцэнтрацыі Н+, тым большы рН;
- г) у растворы кіслаты рН вышэйшы, чым у растворы шчолачы.
2. У нейтральным растворы пры 25 °С:
- а) c(H+) = c(ОH–);
- б) c(H+) < c(ОH–);
- в) рН = 0;
- г) рН = 7.
3. У растворы хлоравадароду канцэнтрацыя іонаў вадароду роўная 0,001 моль/дм3. Для гэтага раствору рН роўны:
- а) 0,001;
- б) 1;
- в) 2;
- г) 3.
4. У растворы Вa(OH)2 канцэнтрацыя іонаў Ва2+ роўная 0,005 моль/дм3. Для гэтага раствору рН роўны:
- а) 0,005;
- б) 2;
- в) 9;
- г) 12.
5. рН < 7 маюць растворы:
- а) лімоннага соку;
- б) страўнікавага соку;
- в) вапнавай вады;
- г) аміячнай вады