§ 25. Электралітычная дысацыяцыя рэчываў у растворах

Да пачатку XIX стагоддзя прыродазнаўцы ўстанавілі, што ўсе растворы можна падзяліць на дзве вялікія групы — якія не праводзяць электрычны ток і якія яго праводзяць. Нямецкі фізік Г. С. Ом выявіў, што растворы-праваднікі праводзяць ток па тых жа законах, што і металы-праваднікі. Англійскі фізік М. Фарадэй вывучыў з’яву электролізу і ўстанавіў яго асноўныя законы. Убачаныя ў растворах з’явы і заканамернасці ў 1887 годзе патлумачыў шведскі вучоны Свантэ Арэніус, які прапанаваў тэорыю электралітычнай дысацыяцыі. Яе сутнасць можна выказаць наступным чынам:
электраліты распадаюцца на іоны ў расплаве пад дзеяннем высокай тэмпературы, а ў растворах у выніку ўзаемадзеяння з растваральнікам (мал. 56).
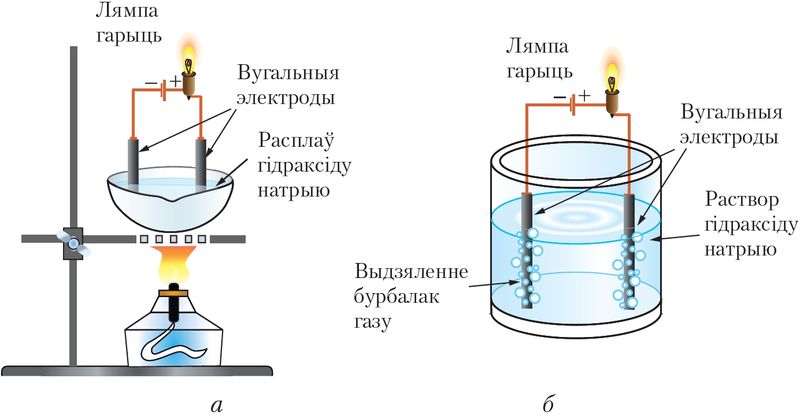
Працэс распаду электраліта на іоны называюць электралітычнай дысацыяцыяй.
У цвёрдым стане большасць іонных і малекулярных злучэнняў — гэта дыэлектрыкі, якія не праводзяць ток. Так, электраправоднасць цвёрдага NaCl у 1000 млрд разоў меншая, чым у металаў або графіту. У той жа час водныя растворы электралітаў праводзяць ток, таму што іонныя і многія малекулярныя злучэнні пад уплывам палярных малекул вады пры растварэнні распадаюцца (дысацыіруюць) на катыёны і аніёны.
Электраліт — гэта рэчыва, якое праводзіць электрычны ток у выніку дысацыяцыі на катыёны і аніёны ў расплаве або ў растворы.
Электраправоднасць электралітаў абумоўлена рухомасцю катыёнаў і аніёнаў ў расплавах і растворах.
Да электралітаў адносяцца солі, шчолачы, кіслоты, гэта значыць злучэнні з іоннай або кавалентнай палярнай хімічнай сувяззю.