§ 25. Электралітычная дысацыяцыя рэчываў у растворах
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 25. Электралітычная дысацыяцыя рэчываў у растворах |
| Напечатано:: | Гость |
| Дата: | Среда, 16 Июль 2025, 03:28 |

Да пачатку XIX стагоддзя прыродазнаўцы ўстанавілі, што ўсе растворы можна падзяліць на дзве вялікія групы — якія не праводзяць электрычны ток і якія яго праводзяць. Нямецкі фізік Г. С. Ом выявіў, што растворы-праваднікі праводзяць ток па тых жа законах, што і металы-праваднікі. Англійскі фізік М. Фарадэй вывучыў з’яву электролізу і ўстанавіў яго асноўныя законы. Убачаныя ў растворах з’явы і заканамернасці ў 1887 годзе патлумачыў шведскі вучоны Свантэ Арэніус, які прапанаваў тэорыю электралітычнай дысацыяцыі. Яе сутнасць можна выказаць наступным чынам:
электраліты распадаюцца на іоны ў расплаве пад дзеяннем высокай тэмпературы, а ў растворах у выніку ўзаемадзеяння з растваральнікам (мал. 56).
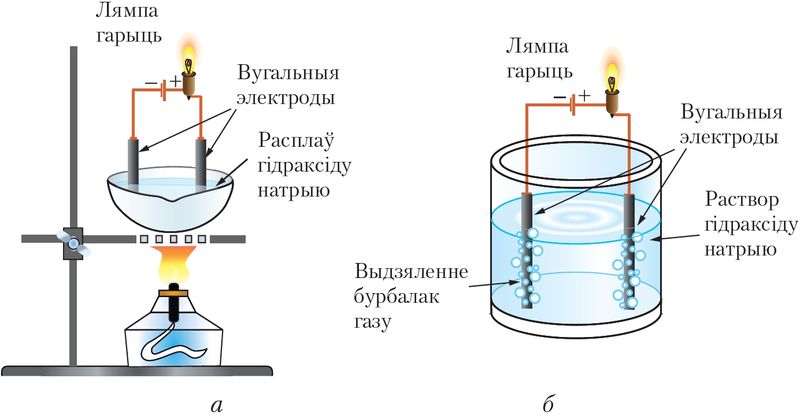
Працэс распаду электраліта на іоны называюць электралітычнай дысацыяцыяй.
У цвёрдым стане большасць іонных і малекулярных злучэнняў — гэта дыэлектрыкі, якія не праводзяць ток. Так, электраправоднасць цвёрдага NaCl у 1000 млрд разоў меншая, чым у металаў або графіту. У той жа час водныя растворы электралітаў праводзяць ток, таму што іонныя і многія малекулярныя злучэнні пад уплывам палярных малекул вады пры растварэнні распадаюцца (дысацыіруюць) на катыёны і аніёны.
Электраліт — гэта рэчыва, якое праводзіць электрычны ток у выніку дысацыяцыі на катыёны і аніёны ў расплаве або ў растворы.
Электраправоднасць электралітаў абумоўлена рухомасцю катыёнаў і аніёнаў ў расплавах і растворах.
Да электралітаў адносяцца солі, шчолачы, кіслоты, гэта значыць злучэнні з іоннай або кавалентнай палярнай хімічнай сувяззю.
Дысацыяцыя злучэнняў з іонным тыпам сувязі
Іонныя крышталі складаюцца з катыёнаў і аніёнаў, звязаных паміж сабой сіламі электрастатычнага ўзаемадзеяння ў спарадкаваную крышталічную структуру. Пад уздзеяннем палярных малекул вады адбываецца разбурэнне іонных крышталёў і іх растварэнне з утварэннем гідратаў іонаў (мал. 57).
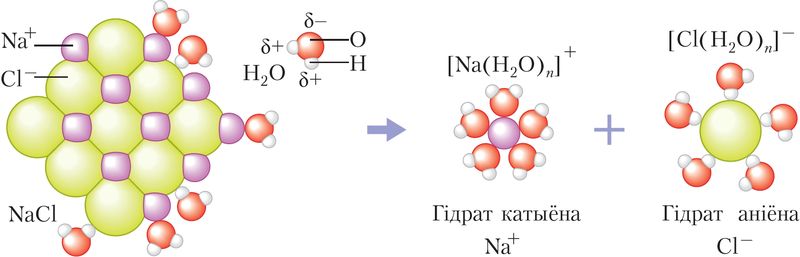
Разгледзьце малюнак 57 і звярніце ўвагу на адносны памер катыёнаў Na+, аніёнаў Cl–, малекул вады, а таксама знакі частковых зарадаў на атамах H і O ў малекуле вады. Звярніце ўвагу на тое, якім атамам малекула вады павернута да катыёнаў Na+, а якім — да аніёнаў Cl–. Чаму малекула вады арыентавана да катыёнаў Na+ атамам кіслароду, а да аніёнаў Cl– — атамам вадароду?
Асаблівасцю дысацыяцыі іонных злучэнняў (солей і шчолачаў) з’яўляецца тое, што гэтыя рэчывы ўжо складаюцца з іонаў і палярныя малекулы вады толькі падзяляюць катыёны і аніёны. Затрачаная на дысацыяцыю энергія кампенсуецца вылучэннем энергіі пры гідратацыі іонаў, і ў цэлым працэс працякае самаадвольна.
З’яўляючыся добра растваральнымі ў вадзе асновамі, шчолачы дысацыіруюць у водных растворах на гідраксід-аніёны і катыёны металу:
У выніку дысацыяцыі солей у вадзе іх іонныя крышталі распадаюцца на катыёны металаў (або амонію) і аніёны кіслотных астаткаў:
Дысацыяцыя злучэнняў з кавалентным палярным тыпам сувязі
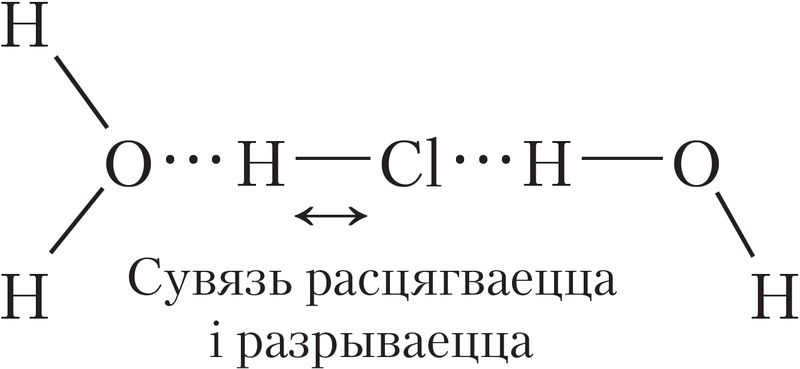
Большасць арганічных і неарганічных кіслот растваральныя ў вадзе і з’яўляюцца электралітамі. У кіслотах атамы вадароду звязаны кавалентнымі палярнымі сувязямі з атамамі кіслотных астаткаў. У палярных малекулах гатовых іонаў няма. Разгледзім працэс дысацыяцыі кіслот на прыкладзе малекулы .
Спачатку палярныя малекулы кіслаты прыцягваюцца да палярных малекул вады і яшчэ больш палярызуюцца.
Утвараюцца вадародныя сувязі паміж малекуламі кіслаты і вады (мал. 58).
Затым кавалентная палярная сувязь падаўжаецца і становіцца менш трывалай. У выніку яна разрываецца, гэта значыць адбываецца ўтварэнне іонаў:
Атрыманы пры дысацыяцыі кіслаты катыён H+ далучаецца да малекулы вады з утварэннем катыёна гідраксонію H3O+ па донарна-акцэптарным механізме, з якім вы пазнаёміліся, вывучаючы матэрыял § 13.
Іон хлору, што ўтварыўся пры іанізацыі, таксама аказваецца гідраціраваным, што паказана на малюнку 57.
Для спрашчэння ўраўненняў рэакцый у іоннай форме звычайна запісваюць гідраціраваны катыён вадароду ў выглядзе Н+.
Аналагічным чынам пад дзеяннем палярных малекул вады адбываецца дысацыяцыя і іншых злучэнняў з кавалентным палярным тыпам сувязі.
Дысацыяцыя ўключае працэсы гідратацыі зыходных малекул, іх палярызацыі, разбурэння сувязей у малекулах і іх распаду з утварэннем гідраціраваных іонаў.
Малекулы кіслот пры дысацыяцыі ў водных растворах поўнасцю або часткова дысацыіруюць на катыёны вадароду і аніёны кіслотных астаткаў:
*Адрозненне хімічных уласцівасцей іонаў ад уласцівасцей атамаў і малекул
Атамы і малекулы з’яўляюцца электранейтральнымі часціцамі. Катыёны металаў, напрыклад K+, як вам вядома, утвараюцца ў выніку таго, што атамы металаў аддаюць электроны. Аніёны неметалаў, напрыклад Br–, утвараюцца ў выніку далучэння электронаў да атамаў неметалаў.
Уласцівасці катыёнаў і аніёнаў адрозніваюцца ад уласцівасцей адпаведных электранейтральных атамаў. Так, у электрычным полі, якое ствараецца электродамі, адбываецца спарадкаваны рух катыёнаў і аніёнаў электраліту — электрычны ток. Дадатныя іоны — катыёны металаў, H+, і іншых перамяшчаюцца да адмоўнага электрода (катода). Адмоўныя іоны — аніёны кіслотных астаткаў і OH– рухаюцца да дадатнага электрода (анода) (мал. 58.1).
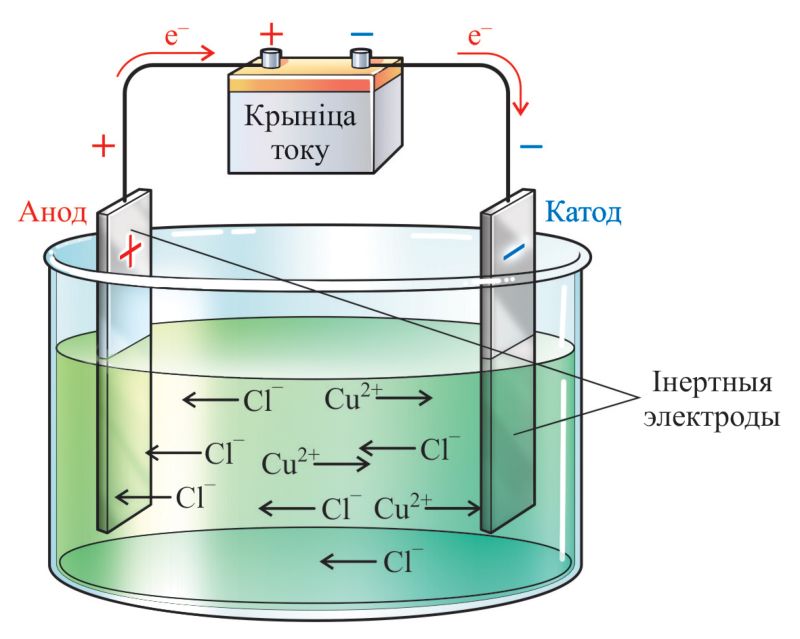
У адрозненне ад нейтральных атамаў (у прыватнасці, атамаў металаў) катыёны, напрыклад Cu2+, Fe3+ і іншыя, маюць меншы лік электронаў на знешніх электронных узроўнях і меншы памер, заўсёды могуць выступаць у якасці акісляльніку і прымаць электроны:
CuSO4 + Zn = ZnSO4 + Cu↓
або Cu2+ + Zn = Zn2+ + Cu↓.
У параўнанні з нейтральнымі атамамі (I, S, O) простыя аніёны, напрыклад I–, S2– , O2– і іншыя, маюць большую колькасць электронаў на знешніх электронных узроўнях і большы памер, могуць выступаць у якасці адноўніку і аддаваць электроны:
2NaI + Cl2 = 2NaCl + I2
або 2I– + Cl2 = 2Cl– + I2.
Моцныя і слабыя электраліты
Адначасова з электралітычнай дысацыяцыяй у растворы электраліту працякаюць працэсы асацыяцыі іонаў. Таму ў электралітах толькі вызначаная доля рэчыва існуе ў выглядзе свабодных іонаў, гэта значыць рэчыва можа не цалкам распадацца на іоны.
Для колькаснай характарыстыкі электралітычнай дысацыяцыі выкарыстоўваюць паняцце ступені дысацыяцыі α.
Ступень дысацыяцыі α — гэта адносіны колькасці малекул або формульных адзінак электраліту, якія распаліся на іоны, да агульнай колькасці яго раствораных малекул або формульных адзінак:
.
Лік часціц і іх колькасць (моль) звязаныя паміж сабой суадносінамі:
, значыць,
,
дзе n — колькасць (моль) адпаведных малекул або формульных адзінак.
Велічыню α выражаюць у долях адзінкі або працэнтах. Ступень дысацыяцыі паказвае, якая частка электраліту распалася і існуе ў растворы ў выглядзе свабодных іонаў. Напрыклад, ступень дысацыяцыі воцатнай кіслаты ў растворы з малярнай канцэнтрацыяй 0,1 моль/дм3 роўная 1,3 %. Гэта азначае, што з 1000 малекул кіслаты толькі 13 распаліся на катыёны H+ і аніёны CH3COO–.
Асацыяцыя іонаў — аб’яднанне рознаіменных іонаў пад дзеяннем электрастатычных сіл у нейтральныя ці зараджаныя часціцы.
Прыкладамі асацыяцыі могуць быць неабарачальныя рэакцыі абмену (яны будуць разгледжаны ў § 27), запісаныя ў іоннай форме:
Ag+ + Cl– = AgCl↓,
або абарачальныя рэакцыі дысацыяцыі слабых кіслот:
.
Здавалася б, моцныя кіслоты ў водных растворах цалкам дысацыіруюць на іоны. Тым не менш змочаная вадой лакмусавая папера чырванее пры змяшчэнні яе над 20–30%-нымі растворамі HCl і HNO3. Гэта сведчыць пра прысутнасць у растворы і парáх над растворам недысацыіраваных малекул HCl і HNO3, якія дысацыіруюць, трапляючы на вільготную паперу. Аднак ужо над 5–10%-нымі растворамі гэтых моцных электралітаў лакмусавая папера не чырванее. Гэта сведчыць пра поўную дысацыяцыю малекул HCl і HNO3 на нелятучыя іоны нават у такіх параўнальна канцэнтраваных растворах.
Можна ацаніць, наколькі моцная дысацыяцыя ў водных растворах аміяку. Змешчаная над разбаўленым растворам аміяку вільготная лакмусавая папера афарбоўваецца ў сіні колер. Гэта тлумачыцца тым, што большая частка аміяку ў вадзе знаходзіцца ў малекулярным стане і знікае. Так, над 4%-ным растворам NH3 лік малекул NH3 у паўтара разы большы за лік малекул пароў вады.
Верагоднасць асацыяцыі іонаў зніжаецца пры памяншэнні канцэнтрацыі электраліту, а значыць, ступень дысацыяцыі ў разбаўленых растворах большая, чым у канцэнтраваных. Гэта азначае, што ступень дысацыяцыі залежыць не толькі ад прыроды рэчыва, але і ад канцэнтрацыі электраліту.
У залежнасці ад колькаснага значэння α электраліты ўмоўна дзеляцца на моцныя і слабыя.
Моцныя электраліты — гэта хімічныя злучэнні, якія ў разбаўленых растворах практычна цалкам дысацыіраваны на іоны. Ступень дысацыяцыі α моцных электралітаў блізкая да 1.
Да моцных электралітаў адносяцца растваральныя іонныя злучэнні і некаторыя рэчывы з кавалентным палярным тыпам сувязі; у іх выпадку практычна адсутнічае працэс асацыяцыі ўтвораных іонаў. Таму ва ўраўненнях, якія адлюстроўваюць электралітычную дысацыяцыю, замест знака роўнасці ставяць стрэлку ў адным кірунку. У якасці прыкладаў прывядзём ураўненні дысацыяцыі растваральных солей (а), шчолачаў (б) і моцных кіслот (в) — H2SO4, HCl, HBr, HI, HClO4, HNO3:
- а)
- б)
- в)
Ступень дысацыяцыі слабых электралітаў складае, як правіла, менш як 5 %. Да слабых электралітаў адносяцца вада (), а таксама:
- • большасць арганічных кіслот, фенол, шэраг неарганічных кіслот: HNO2, HCN, H2S, H3BO3, H2CO3, H2SiO3 і інш.;
- • раствор аміяку ў вадзе.
Слабыя электраліты — хімічныя злучэнні, якія нават у разбаўленых растворах нязначна дысацыіруюць на іоны. Іоны слабых электралітаў знаходзяцца ў рухомай раўнавазе з малекуламі, якія не прадысацыіравалі, або з рэчывам немалекулярнай будовы, якое не растварылася.
Дысацыяцыю слабых электралітаў адлюстроўваюць ураўненнем распаду са стрэлкамі ў двух кірунках: .
Правесці выразную мяжу паміж моцнымі і слабымі кіслотамі даволі цяжка. Прынята лічыць слабай плавіковую кіслату (HF), хоць яна ў разбаўленых растворах дысацыіруе на 8–25 %. Фосфарную H3PO4, сярністую H2SO3 і шчаўевую HOOC—COOH кіслоты таксама лічаць слабымі. Па першай ступені дысацыяцыі яны дысацыіруюць на 10–30 % у канцэнтраваных растворах і на больш як 50 % — у разбаўленых.
Напрыклад, у разбаўленым растворы H3PO4 дысацыіруе згодна з ураўненнем:
Ступень дысацыяцыі α па гэтай ступені можа дасягаць 50 %. На кожнай наступнай ступені значэнне α істотна памяншаецца, а дысацыяцыя працякае паводле ўраўненняў:
Памяншэнне ступені дысацыяцыі звязана з узмацненнем узаемадзеяння іонаў вадароду з кіслотнымі астаткамі ў радзе
,
и
.
Ступень дысацыяцыі α звычайна вызначаюць эксперыментальным шляхам з электраправоднасці раствору.
Дысацыяцыя слабых электралітаў як абарачальная рэакцыя падпарадкоўваецца прынцыпу Ле Шатэлье. Так, утвораныя на першай ступені дысацыяцыі катыёны H+ паводле прынцыпу Ле Шатэлье зрушваюць раўнавагу рэакцыі дысацыяцыі на другой і трэцяй ступені ўлева. Тым самым памяншаецца ступень дысацыяцыі аніёнаў і
і канцэнтрацыя аніёнаў
і
адпаведна.
Як правіла, на кожнай наступнай ступені ступень дысацыяцыі памяншаецца.
У растворы H3PO4 з малярнай канцэнтрацыяй 1 моль/дм3 долі малекул H3PO4 і ўтвораных на розных стадыях аніёнаў ,
і
складаюць:
| H3PO4 | H+ | |||
| 92 % | ~8 % | ~8 % | ~6 · 10–6 % | ~10–16 % |
Усе шматасноўныя слабыя кіслоты дысацыіруюць практычна толькі па першай ступені. Разгледзім яшчэ адзін прыклад дысацыяцыі слабай серавадароднымі кіслаты. На першай ступені невялікая частка малекул H2S дысацыіруе з утварэннем іонаў вадароду і гідрасульфід-іонаў, на другой — з гідрасульфід-іонаў утвараюцца сульфід-іоны:
H2S H+ + HS–;
HS– H+ + S2–.
Дысацыяцыя па другой ступені працякае значна слабей, бо:
- а) лік часціц HS–, якія могуць дысацыіраваць па другой ступені, невялікі;
- б) у адрозненне ад дысацыяцыі малекулы H2S катыён H+ у другой рэакцыі сыходзіць ад аніёна S2– з зарадам –2, а не ад аніёна HS– з зарадам –1, як у першай рэакцыі;
- в) дысацыяцыя па першай ступені суправаджаецца ўтварэннем катыёнаў H+, што прыводзіць да зрушэння раўнавагі дысацыяцыі па другой ступені ўлева і падаўлення гэтага працэсу.
Электраліты — гэта рэчывы, водныя растворы або расплавы якіх праводзяць электрычны ток.
Працэс дысацыяцыі малекулярных злучэнняў з кавалентнымі палярнымі сувязямі адрозніваецца ад працэсу дысацыяцыі іонных злучэнняў наяўнасцю стадыі палярызацыі малекул і разрыву кавалентнай сувязі.
Па ступені дысацыяцыі адрозніваюць моцныя і слабыя электраліты.
Ступень дысацыяцыі залежыць не толькі ад прыроды рэчываў, але і ад канцэнтрацыі раствораў, і павялічваецца з іх развядзеннем.
Пытанні, заданні, задачы
1. Чаму солі праводзяць электрычны ток пасля плаўлення?
2. Чым адрозніваецца электрычны ток у металах ад электрычнага току ў растворах або расплавах электралітаў?
3. Складзіце ўраўненні дысацыяцыі наступных рэчываў: KHCO3, HClO4, Sr(OH)2, LiOH, КHSO4, NH4H2PO4, HNO2.
4. Чаму электралітычная дысацыяцыя ў растворах працякае самаадвольна?
5. Супастаўце акісляльную і аднаўленчую здольнасці:
- а) атама алюмінію і іона Al3+;
- б) атама жалеза і іона Fe2+;
- в) атама серы і сульфід-іона;
- г) атама серы S0 і атама серы ў саставе кіслотнага астатку
6. Чаму для аніёнаў большасці многаасноўных кіслот, напрыклад ,
,
,
, дысацыяцыя па другой ступені працякае слабей, чым па першай? Як зменіцца ступень дысацыяцыі пры дабаўленні іонаў вадароду ў растворы гэтых кіслот?
7. У водным растворы ўтрымліваецца фторавадарод колькасцю 50 моль. Чаму роўная сумарная колькасць іонаў, якія ўтварыліся пры яго дысацыяцыі, калі α(HF) = 9 %?
8. Вызначце сумарную колькасць катыёнаў і аніёнаў солі ў растворы, які ўтрымлівае сульфат натрыю масай 2,84 г.
9. Чаму роўная малярная канцэнтрацыя катыёнаў H+ у водным растворы воцатнай кіслаты аб’ёмам 4 дм3, калі ступень дысацыяцыі кіслаты роўная 2,6 %, а маса кіслаты — 6 г?
10. У растворы аб’ёмам 2,5 дм3 маса Ba(OH)2 роўная 14 г. Вылічыце малярную канцэнтрацыю іонаў OH– у дадзеным растворы.
*Самакантроль
1. Дысацыяцыя як NaCl, так і HCl уключае:
- а) гідратацыю хларыд-іонаў;
- б) падаўжэнне кавалентнай сувязі і яе разрыў; заўвага;
- в) гідратацыю катыёнаў;
- г) палярызацыю малекул і іх распад з утварэннем іонаў.
2. Іон F– адрозніваецца ад атама фтору F:
- а) колькасцю электронных слаёў;
- б) зарадам ядра;
- в) колькасцю электронаў на знешнім слоі;
- г) памерамі.
3. У растворы нейкай солі ўтрымліваецца 2 моль катыёнаў і 3 моль аніёнаў. Гэтай соллю можа быць:
- а) Аl2(SO4)3;
- б) СаСl2;
- в) Fe2(SO4)3;
- г) Na2CO3.
4. Ураўненні дысацыяцыі слабых электралітаў:
- а) H2SO3
2H++
;
- б) H2O
H+ + ОH–;
- в) С6Н5ОН
С6Н5О– + Н+;
- г) Са(OH)2 → Са2+ + 2ОН–.
5. У растворы азоцістай кіслаты лік непрадысацыіраваных малекул у 4 разы большы за лік прадысацыіраваных. Ступень дысацыяцыі кіслаты роўная:
- а) 0,02;
- б) 20 %;
- в) 0,25;
- г) 25 %.