§ 21. Фактары, якія ўплываюць на скорасць хімічных рэакцый
Каталізатары
Правядзенне хімічных рэакцый у прысутнасці каталізатараў з’яўляецца адным з асноўных спосабаў павелічэння скорасці ператварэнняў рэчываў.
Каталіз — гэта працэс паскарэння хімічнай рэакцыі пад дзеяннем каталізатара.
Нагадаем, што каталізатары паскараюць хімічныя рэакцыі, але не ўваходзяць у састаў канчатковых прадуктаў. Колькасць каталізатара, у адрозненне ад іншых рэагентаў, практычна не змяняецца пасля рэакцыі. Хімічныя рэакцыі ў прысутнасці каталізатара працякаюць хутчэй, паколькі ён забяспечвае альтэрнатыўны шлях ператварэння.
Разгледзім дзеянне каталізатара на прыкладзе рэакцыі:
А2 + Б2 = 2АБ.
Без каталізатара гэтая рэакцыя працякае павольна. Каталізатар K хутка рэагуе з адным з зыходных рэчываў, напрыклад А2, і ўтварае рэакцыйназдольнае прамежкавае злучэнне А2K:
А2 + K = А2K (хуткая рэакцыя).
Прамежкавае злучэнне A2K актыўна ўзаемадзейнічае з іншым рэагентам Б2, ператвараючыся ў прадукт рэакцыі АБ. Каталізатар K вызваляецца без змянення:
А2K + Б2 = 2АБ + K (хуткая рэакцыя).
Узаемадзеянне рэагентаў A2 і Б2 па многастадыйным каталітычным шляху ў цэлым працякае значна хутчэй, чым без каталізатара.
Каталізатар шмат разоў уступае ў хімічнае ўзаемадзеянне з удзельнікамі ператварэння, але свой хімічны састаў аднаўляе. Каталізатар не ўваходзіць у састаў прадуктаў рэакцыі.
Напрыклад, рэакцыя этэрыфікацыі паміж карбонавай кіслатой і спіртам працякае значна хутчэй у прысутнасці моцнай мінеральнай кіслаты:
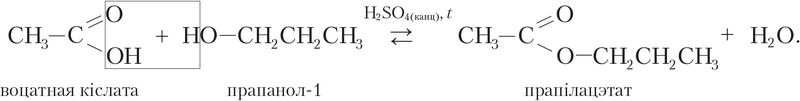
Для акіслення аксіду серы(IV) SO2 ў аксід серы(VI) SO3 кіслародам паветра выкарыстоўваюць каталізатар V2O5:
Скорасць гэтай рэакцыі ў прысутнасці каталізатара павялічваецца прыкладна ў 10 000 разоў.