§ 21. Фактары, якія ўплываюць на скорасць хімічных рэакцый
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 21. Фактары, якія ўплываюць на скорасць хімічных рэакцый |
| Напечатано:: | Гость |
| Дата: | Среда, 13 Август 2025, 19:54 |
Веданне скарасцей хімічных рэакцый і заканамернасцей іх працякання мае вялікае навуковае і практычнае значэнне. Напрыклад, у хімічнай прамысловасці ад скорасці рэакцый залежаць канструкцыя, памеры і прадукцыйнасць апаратуры і нават бяспека вытворчасці.
Як было адзначана ў папярэднім параграфе, скорасць хімічнай рэакцыі вызначаецца прыродай рэагуючых рэчываў. Але скорасць можна павялічыць або паменшыць, змяняючы ўмовы працякання рэакцыі.
Да фактараў, якія істотна ўплываюць на скорасць хімічных рэакцый, адносяцца канцэнтрацыя рэагентаў, тэмпература, наяўнасць і прырода каталізатара, плошча паверхні судакранання рэагентаў.
Канцэнтрацыя рэагуючых рэчываў

Скорасць рэакцыі прапарцыянальная ліку сутыкненняў часціц рэагуючых рэчываў. Чым вышэйшыя канцэнтрацыі зыходных рэчываў у рэакцыйнай сумесі (растворы), тым часцей іх часціцы сутыкаюцца паміж сабой, што і прыводзіць да павелічэння скорасці рэакцыі.
Тэмпература
Скорасць большасці хімічных рэакцый моцна залежыць ад тэмпературы. Гэтую залежнасць ў 1884 годзе ўстанавіў галандскі хімік Я. Х. Вант-Гоф — першы лаўрэат Нобелеўскай прэміі па хіміі. Ён сфармуляваў правіла, якое потым назвалі яго імем.
Пры павышэнні тэмпературы на кожныя 10 °С скорасць большасці хімічных рэакцый павялічваецца ў 2–4 разы.
Матэматычны выраз залежнасці скорасці рэакцыі ад тэмпературы мае выгляд: υ2 = υ1 ∙ γΔt/10, дзе:
- υ2 — скорасць рэакцыі пры больш высокай тэмпературы t2;
- υ1 — скорасць рэакцыі пры больш нізкай тэмпературы t1;
- Δt — рознасць тэмператур t2 и t1;
- γ — каэфіцыент Вант-Гофа, які паказвае, у колькі разоў павялічваецца скорасць рэакцыі пры павышэнні тэмпературы на кожныя 10 °С.
Так, калі γ = 3, а пры 20 °С рэакцыя доўжыцца каля 10 гадзін, то пры 100 °С яна пройдзе прыкладна за 6 секунд. Для большасці практычна значных рэакцый γ мае значэнні ад 2 да 4.
Вывучаючы, як змяняюцца ўласцівасці палімераў, лекаў, алеяў, змазак і многіх іншых матэрыялаў у працэсе захоўвання, іх вытрымліваюць нейкі час пры павышаных тэмпературах. Гэта значна паскарае хімічныя рэакцыі распаду, гідролізу, акіслення рэчываў і іншыя натуральныя працэсы, працяканне якіх у выніку прыводзіць да непрыдатнасці матэрыялаў і вырабаў з іх. Такі спосаб тэсціравання называюць паскораным старэннем і выкарыстоўваюць для папярэдняй ацэнкі карыснага тэрміну службы вырабаў або тэрміну іх прыдатнасці (захоўвання).
Вытрымліванне паперы пры 100 °С на працягу 24 гадзін адпавядае тэрміну яе захоўвання на працягу 6–8 гадоў пры пакаёвай тэмпературы. Гэты прыём неабходны для вызначэння працягласці выкарыстання кніг і дакументаў.
Памяншэнне тэмпературы захоўвання харчовых прадуктаў запавольвае хімічныя працэсы іх псавання: акіслення, раскладання і інш. Так, тэрмін прыдатнасці сметанковага масла пры тэмпературах захоўвання +3, –6 і –16 °С складае адпаведна 35, 60 і 120 сутак.
Каталізатары
Правядзенне хімічных рэакцый у прысутнасці каталізатараў з’яўляецца адным з асноўных спосабаў павелічэння скорасці ператварэнняў рэчываў.
Каталіз — гэта працэс паскарэння хімічнай рэакцыі пад дзеяннем каталізатара.
Нагадаем, што каталізатары паскараюць хімічныя рэакцыі, але не ўваходзяць у састаў канчатковых прадуктаў. Колькасць каталізатара, у адрозненне ад іншых рэагентаў, практычна не змяняецца пасля рэакцыі. Хімічныя рэакцыі ў прысутнасці каталізатара працякаюць хутчэй, паколькі ён забяспечвае альтэрнатыўны шлях ператварэння.
Разгледзім дзеянне каталізатара на прыкладзе рэакцыі:
А2 + Б2 = 2АБ.
Без каталізатара гэтая рэакцыя працякае павольна. Каталізатар K хутка рэагуе з адным з зыходных рэчываў, напрыклад А2, і ўтварае рэакцыйназдольнае прамежкавае злучэнне А2K:
А2 + K = А2K (хуткая рэакцыя).
Прамежкавае злучэнне A2K актыўна ўзаемадзейнічае з іншым рэагентам Б2, ператвараючыся ў прадукт рэакцыі АБ. Каталізатар K вызваляецца без змянення:
А2K + Б2 = 2АБ + K (хуткая рэакцыя).
Узаемадзеянне рэагентаў A2 і Б2 па многастадыйным каталітычным шляху ў цэлым працякае значна хутчэй, чым без каталізатара.
Каталізатар шмат разоў уступае ў хімічнае ўзаемадзеянне з удзельнікамі ператварэння, але свой хімічны састаў аднаўляе. Каталізатар не ўваходзіць у састаў прадуктаў рэакцыі.
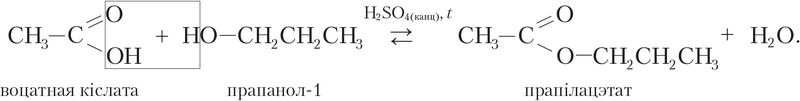
Напрыклад, рэакцыя этэрыфікацыі паміж карбонавай кіслатой і спіртам працякае значна хутчэй у прысутнасці моцнай мінеральнай кіслаты:
Для акіслення аксіду серы(IV) SO2 ў аксід серы(VI) SO3 кіслародам паветра выкарыстоўваюць каталізатар V2O5:
Скорасць гэтай рэакцыі ў прысутнасці каталізатара павялічваецца прыкладна ў 10 000 разоў.
Плошча паверхні судакранання рэагуючых рэчываў
На скорасць гетэрагенных рэакцый моцны ўплыў аказвае велічыня плошчы паверхні судакранання рэагентаў. Правядзём два эксперыменты і пераканаемся ў гэтым. Для гэтага ў дзве прабіркі нальём разбаўленую саляную кіслату роўных аб’ёмаў. У першую прабірку апусцім кавалачак мармуру (CaCO3), а ў другую — мармуровую крошку (СaCO3) той жа масы. Відаць, што больш інтэнсіўнае вылучэнне газу адбываецца ў прабірцы з крошкай, і рэакцыя з ёй працякае хутчэй, чым з кавалачкам мармуру.
З паўсядзённага вопыту вам вядома, што драўляныя стружкі і трэскі згараюць хутчэй, чым палена з таго ж дрэва і той жа масы. Гэта тлумачыцца тым, што ў стружак агульная плошча падпаленай паверхні намнога большая, чым у палена.
Такім чынам, большая плошча паверхні судакранання рэагентаў забяспечвае большую верагоднасць кантакту часціц, якія ўзаемадзейнічаюць, і павелічэнне скорасці гетэрагенных рэакцый. Гранічным выпадкам «драблення» рэагентаў з’яўляецца іх растварэнне і выкарыстанне ў выглядзе раствораў.
На скорасць хімічных рэакцый уплываюць канцэнтрацыя рэагентаў, тэмпература, наяўнасць каталізатара і плошча паверхні судакранання рэагентаў.
Каталізатары, забяспечваючы альтэрнатыўны шлях ператварэння, паскараюць хімічныя рэакцыі, але не ўваходзяць у састаў канчатковых прадуктаў ператварэнняў.
Пытанні, заданні, задачы
1. Укажыце размяшчэнне магнію, цынку, жалеза і медзі ў радзе актыўнасці металаў. Як гэта адбіваецца на скорасці іх рэакцыі з растворамі кіслот?
2. Чаму для працякання хімічнай рэакцыі, як правіла, недастаткова простага сутыкнення часціц рэагентаў? Якія працэсы папярэднічаюць утварэнню новых сувязей у прадуктах рэакцыі?
3. Што такое энергія актывацыі рэакцыі? Чаму малекулы рэагентаў, якія маюць запас энергіі меншы, чым Еа, не ўступаюць у хімічную рэакцыю?
4. Прапануйце шляхі павелічэння скорасці рэакцыі:
2Al(OH)3 = Al2O3 + 3H2O – Q.
5. Чаму скорасць большасці рэакцый узрастае пры павышэнні тэмпературы?
6. Чаму многія лекі захоўваюць у халадзільніку?
7. Якія рэчывы называюцца каталізатарамі? Прывядзіце прыклады вядомых вам рэакцый, якія працякаюць у прысутнасці каталізатараў.
8. Пералічыце ўсе фактары, якія павялічваюць скорасць рэакцыі сінтэзу аміяку:
9. У закрытай пасудзіне пастаяннага аб’ёму працякае хімічная рэакцыя: А(г) + Б(г) = В(г). Да пачатку рэакцыі малярная канцэнтрацыя A складала 5 моль/дм3. Скорасць рэакцыі па рэчыве А роўная 0,06 моль/(дм3 ∙ с). Разлічыце канцэнтрацыю рэчыва A праз 20 с пасля пачатку рэакцыі.
10. У хімічны рэактар аб’ёмам 50 дм3 увялі газападобнае рэчыва А колькасцю 20 моль і газападобнае рэчыва Б колькасцю 60 моль, паміж якімі адбылася рэакцыя А(г) + 2Б(г) = В(г). Праз 3 мінуты канцэнтрацыя рэчыва А паменшылася напалову. Вызначце скорасць расходавання рэчыва Б.
*Самакантроль
1. Хуткасць хімічных рэакцый залежыць ад:
- а) паверхні судакранання рэчываў;
- б) тэмпературы;
- в) колькасці рэчыва;
- г) малярнай канцэнтрацыі рэчыва.
2. Узаемадзеянне гранул цынку з салянай кіслатой будзе паскарацца пры:
- а) павелічэнні канцэнтрацыі кіслаты;
- б) драбненні цынкавых гранул;
- в) астуджэнні рэакцыйнай сумесі;
- г) развядзенні кіслаты.
3. Без каталізатара працякаюць рэакцыі:
- а) NaOH + HCl = NaCl + H2O;
- б) BaCl2 + H2SO4 = BaSO4↓+ HCl;
- в) C2H4 + H2 = C2H6;
- г) AgNO3 + NaCl = AgCl↓ + NaNO3.
4. У табліцы прыведзены значэнні энергіі актывацыі для рэакцыі раскладання пераксіду вадароду 2H2O2 = 2H2O + O2↑ без і ў прысутнасці каталізатара:
| Наяўнасць каталізатара | Энергія актывацыі, кДж/моль |
|---|---|
| Без каталізатара | 73 |
| Плаціна | 48 |
| Іоны жалеза | 42 |
| Фермент каталаза | 7 |
Хуткасць раскладання пераксіду вадароду будзе найбольшай:
- а) на плацінавым каталізатары;
- б) прыведзеныя дадзеныя не дазваляюць зрабіць такой высновы;
- в) пры ферментатыўным раскладанні ў прысутнасці каталазы;
- г) пры адсутнасці каталізатараў.
5. Пры павелічэнні тэмпературы на кожныя 10 °С хуткасць нейкай рэакцыі ўзрастае ўдвая. Тэмпература рэакцыйнай сумесі змянілася ад 20 °С да 60 °С. Хуткасць рэакцыі пры гэтым узрасла:
- а) у 8 разоў;
- б) у 16 разоў;
- в) у 64 разы;
- г) у 128 разоў.