§ 18. Класіфікацыя і агульныя характарыстыкі хімічных рэакцый
Хімічныя ператварэнні можна класіфікаваць па шэрагу крытэрыяў.
1. Па колькасці і саставу зыходных рэчываў і рэчываў, якія ўтвараюцца, адрозніваюць рэакцыі злучэння, раскладання, замяшчэння і абмену.
Рэакцыя злучэння — гэта хімічнае ператварэнне, у выніку якога з двух або больш рэчываў утвараецца адно новае рэчыва:
У рэакцыях злучэння могуць удзельнічаць як простыя, так і складаныя рэчывы, але прадуктамі з’яўляюцца толькі складаныя рэчывы.
Рэакцыя раскладання — гэта хімічнае ператварэнне, у выніку якога з аднаго складанага рэчыва ўтвараецца некалькі новых — простых або складаных:
Раскладанню падвяргаюцца толькі складаныя рэчывы.
Рэакцыя замяшчэння — гэта хімічнае ператварэнне, у выніку якога атамы простага рэчыва замяшчаюць атамы аднаго з элементаў у складаным:
Рэакцыя абмену — гэта хімічнае ператварэнне, у выніку якога два складаныя рэчывы абменьваюцца сваімі састаўнымі часткамі.
Напрыклад:
або ў іоннай форме, вядомай вам з 9-га класа:
2. Па прыкмеце змянення ступеней акіслення атамаў у хімічных ператварэннях вылучаюць акісляльна-аднаўленчыя рэакцыі і рэакцыі без змянення ступені акіслення атамаў.
Рэакцыі абмену, некаторыя рэакцыі злучэння і раскладання працякаюць без змянення ступені акіслення атамаў:
Рэакцыі замяшчэння, некаторыя рэакцыі раскладання і злучэння суправаджаюцца змяненнем ступеней акіслення атамаў:
Адзначым, што змяненнем ступеней акіслення атамаў суправаджаюцца амаль усе рэакцыі з удзелам простых рэчываў.
Акісляльна-аднаўленчыя рэакцыі ажыццяўляюцца за кошт пераходу электронаў ад атамаў адных элементаў да атамаў другіх, у выніку чаго і адбываецца змяненне ступеней акіслення. Пры гэтым лік электронаў, аддадзеных адноўнікам, роўны ліку электронаў, прынятых акісляльнікам. Гэтая роўнасць называецца, як вам вядома, электронным балансам і выкарыстоўваецца для расстаноўкі каэфіцыентаў ва ўраўненнях акісляльна-аднаўленчых рэакцый.
Прыклад 1. Расстаўце каэфіцыенты ва ўраўненні рэакцыі прамысловага атрымання аксіду азоту(II) з аміяку:
Рашэнне
Як відаць са схемы, атам азоту N павышае ступень акіслення ад –3 да +2, значыць, страчвае 5 электронаў. Кожны з двух атамаў кіслароду O паніжае ступень акіслення ад 0 да –2, такім чынам, двухатамная малекула кіслароду далучае 4 электроны:
Найменшае агульнае кратнае для лікаў 4 і 5 роўнае 20. Каэфіцыенты знаходзім дзяленнем кратнага на лік электронаў. Яны ўяўляюць сабой множнікі для дасягнення электроннага балансу 20 электронаў:
| 5 | 20 | x 4 | адноўнік | акісляецца | |
| 4 | x 5 | акісляльнік | аднаўляецца |
Расставім каэфіцыенты:
3. Па прыкмеце вылучэння або паглынання цеплаты хімічныя рэакцыі падзяляюць на экзатэрмічныя і эндатэрмічныя.
Экзатэрмічнымі называюць рэакцыі, якія суправаджаюцца вылучэннем цеплаты ў навакольнае асяроддзе.
Цеплату, якая вылучаецца, ва ўраўненні рэакцыі абазначаюць сімвалам Q са знакам плюс, паказваючы такім чынам, што сістэма перадае сваю энергію навакольнаму асяроддзю. Энергія можа перадавацца таксама ў выглядзе светлавога выпраменьвання або электрычнай энергіі. Звычайна экзатэрмічныя рэакцыі выкарыстоўваюць для атрымання цеплаты. Тыповы прыклад — рэакцыя гарэння метану:
Эндатэрмічнымі называюць рэакцыі, якія суправаджаюцца паглынаннем цеплаты з навакольнага асяроддзя. Цеплату, што ўбывае, ва ўраўненні рэакцыі абазначаюць сімвалам Q са знакам мінус:
4. Па прыкмеце паўнаты ператварэння зыходных рэчываў у канчатковыя хімічныя рэакцыі дзеляць на неабарачальныя і абарачальныя.
Неабарачальнымі называюць хімічныя рэакцыі, якія працякаюць у дадзеных умовах з поўным ператварэннем хаця б аднаго з зыходных рэчываў у прадукты рэакцыі.
Калі рэагуючыя рэчывы ўзяты ў стэхіяметрычных колькасцях, то ўсе яны прарэагуюць цалкам у выпадку неабарачальнай хімічнай рэакцыі.
Да неабарачальных адносяцца рэакцыі з інтэнсіўным вылучэннем цеплаты (напрыклад, гарэння: ), а таксама рэакцыі ў растворах з утварэннем маларастваральных (
), газападобных (
) рэчываў або рэчываў, якія мала дысацыіруюць (напрыклад, вада):
Абарачальнымі называюць хімічныя рэакцыі, здольныя працякаць у дадзенных умовах адначасова ў прамым і зваротным напрамках. У ходзе абарачальнай рэакцыі зыходныя рэчывы ператвараюцца ў прадукты рэакцыі не цалкам таму, што адначасова з прадуктаў утвараюцца зыходныя рэчывы.
Ва ўраўненнях абарачальных рэакцый знак роўнасці замяняюць процілегла накіраванымі стрэлкамі. Напрыклад, абарачальныя рэакцыі атрымання аксіду серы(VI):
а таксама ўзаемадзеяння азоту з кіслародам, якое становіцца адчувальным толькі вышэй за 2000 °С і працякае ў атмасферы пры разрадах маланкі.
5. Па ўмовах правядзення рэакцыі дзеляць на каталітычныя і некаталітычныя.
Каталітычныя рэакцыі працякаюць з удзелам каталізатараў.
Каталізатары — гэта рэчывы, якія паскараюць хімічныя рэакцыі, але не ўваходзяць у састаў прадуктаў ператварэнняў.
Каталізатар указваюць над знакам роўнасці або абарачальнасці рэакцыі, як правіла, з кароткімі пазначэннямі ўмоў яе працякання (t, р), напрыклад:
Многія рэакцыі працякаюць з дастатковай скорасцю толькі ў прысутнасці каталізатара. Так, вядома, што чысты пераксід вадароду ўстойлівы і раскладаецца пры 20 °С са скорасцю, меншай за 0,5 % у год. Аднак пры наяўнасці малой колькасці прымесей, напрыклад злучэнняў медзі, жалеза, марганцу, серабра, многіх арганічных рэчываў, пераксід вадароду няўстойлівы нават у разбаўленых растворах:
6. Па наяўнасці мяжы падзелу фаз вылучаюць рэакцыі гамагенныя і гетэрагенныя. Хімічныя рэакцыі, якія працякаюць ва ўсім аб’ёме аднароднага рэакцыйнага асяроддзя (напрыклад, у сумесі газаў, у растворы дзвюх солей у вадзе), называюць гамагеннымі. Напрыклад:
Рэакцыі, якія працякаюць на паверхні судакранання розных рэчываў у неаднародным асяроддзі, з’яўляюцца гетэрагеннымі. Такую паверхню называюць мяжой падзелу фаз, разумеючы пад фазай аднародную па саставе і ўласцівасцях частку сістэмы. Напрыклад, у рэакцыі медзі з канцэнтраванай сернай кіслатой, ураўненне якой:
цвёрдая медзь аддзелена ад вадкай сернай кіслаты бачнай мяжой — паверхняй кавалачка медзі. З паверхні медзі падымаюцца бурбалкі газу — SO2. Гэтая рэакцыя з’яўляецца гетэрагеннай. Да гетэрагенных адносяць рэакцыі растварэння металаў і іх аксідаў у кіслотах, гарэнне цвёрдых рэчываў у кіслародзе, узаемадзеянне паміж кіслотнымі і асноўнымі аксідамі і інш.
У якасці прыкладу гетэрагеннай хімічнай рэакцыі можна прывесці высокатэмпературны працэс атрымання жалеза з аксіду жалеза Fe2O3:
Гетэрагенныя хімічныя рэакцыі працякаюць на паверхні судакранання рэагуючых рэчываў.
Гамагеннымі называюць хімічныя рэакцыі, што працякаюць у аднародным асяроддзі ў адсутнасці паверхні судакранання розных рэчываў.
У шэрагу выпадкаў рэакцыі, што павольна працякаюць у растворах або ў пары, паскараюцца пры ўвядзенні цвёрдага каталізатара. Так, вядомая вам рэакцыя сінтэзу аміяку з азоту і вадароду паскараецца ў прысутнасці жалеза; V2O5 выкарыстоўваюць у рэакцыі акіслення SO2 пры сінтэзе сернай кіслаты. Па прыкмеце наяўнасці мяжы падзелу фаз гэтыя рэакцыі адносяць да гетэрагенных, называючы іх рэакцыямі гетэрагеннага каталізу.
Прыклад 2. Дайце характарыстыку рэакцыі гарэння жалеза ў хлоры, якая працякае з утварэннем хларыду жалеза(III) і якая суправаджаецца інтэнсіўным вылучэннем цеплаты і святла.
Рашэнне
Складзём ураўненне рэакцыі і адзначым ступені акіслення атамаў, агрэгатны стан зыходных рэчываў і цеплавы эфект:
Такім чынам, гэта рэакцыя:
- 1) злучэння, паколькі з двух простых зыходных рэчываў — жалеза і хлору — утвараецца адно новае — складанае рэчыва хларыд жалеза(iii);
- 2) акісляльна-аднаўленчая, паколькі ў ходзе рэакцыі змяняюцца ступені акіслення атамаў жалеза і хлору;
- 3) экзатэрмічная, таму што гарэнне суправаджаецца вылучэннем цеплаты;
- 4) неабарачальная як рэакцыя гарэння з інтэнсіўным вылучэннем цеплаты;
- 5) некаталітычная, паколькі працякае без каталізатара;
- 6) гетэрагенная, паколькі працякае на паверхні падзелу цвёрдага і газападобнага рэчываў.
Класіфікацыя реакцый у арганічнай хіміі
Пры класіфікацыі рэакцый у арганічнай хіміі адрозніваюць рэакцыі: замяшчэння атама або груп атамаў у малекуле арганічнага злучэння; далучэння атамаў або груп атамаў да малекулы арганічнага злучэння; адшчаплення атамаў ад малекулы без разрыву сувязей ; раскладання як працэсу разрыву сувязей з утварэннем больш простых рэчываў; ізамерызацыі як працэсу змянення будовы малекулы з захаваннем яе саставу.
Прыкладамі могуць служыць наступныя ператварэнні:
i (замяшчэнне););
(далучэнне););
(адшчапленне););
(раскладанне););
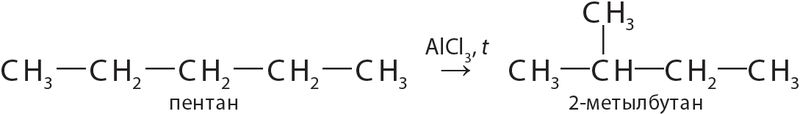 (ізамерызацыя).).
(ізамерызацыя).).Па прыкмеце змянення ступеней акіслення атамаў у малекуле арганічнага рэчыва, як і ў выпадку неарганічных рэчываў, адрозніваюць рэакцыі акіслення (з удзелам кіслароду, перманганату калію KМnO4, храмату і дыхрамату калію — K2CrO4 і K2Cr2O7 і інш.) і рэакцыі аднаўлення (з удзелам вадароду, LiAlH4 і інш.):
(акісленне);
(аднаўленне).