§ 15. Валентнасць і ступень акіслення
Ступень акіслення
У выпадку рэчываў з іоннымі або палярнымі сувязямі для характарыстыкі стану атамаў, што ўтвараюць гэтыя сувязі, выкарыстоўваюць паняцце ступень акіслення. Як вы ўжо ведаеце з матэрыялу параграфа § 11, ступень акіслення атама — гэта ўмоўны зарад, які прыпісваюць атаму, дапускаючы, што ён утварае з суседнімі атамамі толькі іонныя сувязі.
Колькаснае значэнне ступені акіслення атама ў канкрэтным злучэнні вызначаюць па колькасці электронаў, зрушаных пры ўтварэнні сувязі або перададзеных суседнім атамам. Так, cтупень акіслення атамаў азоту ў малекулах простага рэчыва ![]() роўная 0 (электроны не зрушаныя, сувязь кавалентная непалярная). У малекуле аміяку азот праяўляе ступень акіслення –3, паколькі да атама азоту зрушыліся тры электроны ад атамаў вадароду. Атамы вадароду пры гэтым маюць ступень акіслення +1.
роўная 0 (электроны не зрушаныя, сувязь кавалентная непалярная). У малекуле аміяку азот праяўляе ступень акіслення –3, паколькі да атама азоту зрушыліся тры электроны ад атамаў вадароду. Атамы вадароду пры гэтым маюць ступень акіслення +1.
Пры вылічэннях улічваюць, што алгебраічная сума ступеней акіслення ўсіх атамаў у злучэнні роўная 0.
Не варта забываць, што атамы некаторых элементаў маюць пастаяннае значэнне ступені акіслення ў сваіх злучэннях (,
,
,
і інш.). Найбольш электраадмоўныя атамы ў канкрэтным злучэнні звычайна маюць найніжэйшую ступень акіслення.
Так, у малекуле CF4 найбольшая электраадмоўнасць у фтору, яго атамы маюць ступень акіслення –1. Такім чынам, вуглярод знаходзіцца ў ступені акіслення +4, гэта значыць .
У перманганаце калію KMnO4 калій мае пастаянную ступень акіслення, кісларод як найбольш электраадмоўны элемент знаходзіцца ў найніжэйшай ступені акіслення –2, таму ступень акіслення марганцу можна знайсці з роўнасці 0 = (+1) + х + 4(–2), гэта значыць .
У многіх кавалентных злучэннях абсалютная велічыня ступені акіслення элементаў роўная іх валентнасці. Напрыклад, азот у малекуле аміяку мае валентнасць 3 і ступень акіслення –3. У выпадку іонных злучэнняў атамаў металаў з р-элементамі V–VII-груп выкарыстоўваюць паняцце «ступень акіслення». Напрыклад, у хларыду кальцыю СаCl2 ступень акіслення хлору –1, а кальцыю — +2.
Валентнасць можа адрознівацца ад ступені акіслення. Гэта характэрна, напрыклад, для простых рэчываў, у малекулах якіх ступень акіслення атамаў заўсёды роўная нулю, а валентнасць — ліку агульных электронных пар.
Так, у малекуле кіслароду валентнасць кіслароду роўная 2, а ступень акіслення 0. У якасці іншага прыкладу прывядзём малекулу пераксіду вадароду
. У ёй кісларод двухвалентны, а вадарод аднавалентны. У той жа час ступені акіслення абодвух элементаў па абсалютнай велічыні роўныя 1:
. Не супадаюць значэнні ступені акіслення і валентнасці азоту ў іоне амонію (–3, 4)
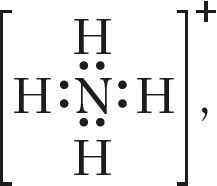 , малекуле азотнай кіслаты (+5, 4)
, малекуле азотнай кіслаты (+5, 4) .
Ступень акіслення атамаў вызначае характар магчымых хімічных узаемадзеянняў з удзелам гэтых атамаў. Так, элемент у найніжэйшай ступені акіслення (у дадзеным выпадку азот у ступені акіслення –3) можа выступаць толькі як адноўнік:
Элемент у найвышэйшай ступені акіслення (азот, +5) можа быць толькі акісляльнікам:
У прамежкавай ступені акіслення элемент (азот, +2) можа быць як акісляльнікам, так і адноўнікам:
(азот — адноўнік, акісляецца);
(азот — акісляльнік, аднаўляецца).
Найвышэйшая ступень акіслення атама А-групы роўная нумару групы (за выключэннем высакародных газаў, фтору і кіслароду). Найніжэйшая, адмоўная, ступень акіслення роўная нумару А-групы мінус 8.