§ 15. Валентнасць і ступень акіслення
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Падручнік: | § 15. Валентнасць і ступень акіслення |
| Надрукаваны: | Госць |
| Дата: | Аўторак 12 Жнівень 2025 |
Валентнасць
Здольнасць атамаў далучаць да сябе строга вызначаны лік іншых атамаў характарызуецца з дапамогай валентнасці.
Найбольш проста растлумачыць, што такое валентнасць, можна на прыкладзе злучэнняў з кавалентнымі сувязямі. У такіх злучэннях валентнасць атамаў асобнага элемента прынята вызначаць лікам кавалентных сувязей, якія ўтварыліся.
Напрыклад, валентнасць кіслароду ў малекулах вады , пераксіду вадароду
, метаналю
![]() роўная двум.
роўная двум.
Валентнасць азоту ў простым рэчыве аміяку
![]() роўная тром, а ў іоне амонію — чатыром:
роўная тром, а ў іоне амонію — чатыром: 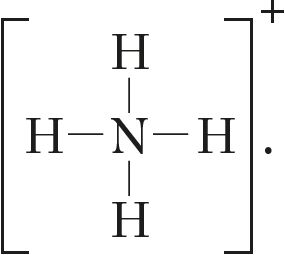
Прагназуючы лік магчымых валентнасцей атама якога-небудзь элемента ў розных злучэннях, мы ўказваем валентныя магчымасці атама. Валентныя магчымасці атама вызначаюцца:
- а) лікам няспараных валентных электронаў, здольных прыняць удзел ва ўтварэнні хімічных сувязей па абменным механізме;
- б) лікам знешніх атамных арбіталей (вакантных або запоўненых), здольных утварыць хімічную сувязь па донарна-акцэптарным механізме.
Разгледзім валентныя магчымасці атама фосфару з улікам ліку яго няспараных электронаў. Электронная канфігурацыя валентнасці слоя атама фосфару ў асноўным стане — 3s23p33d0, што дае яму магчымасць утварыць толькі тры сувязі па абменным механізме: 15P ![]()
Але атам фосфару здольны ўтварыць і пяць сувязей, калі адзін 3s-электрон перавесці ва ўзбуджаны стан. Пры гэтым электронная канфігурацыя атама фосфару будзе мець выгляд 3s13p33d1:
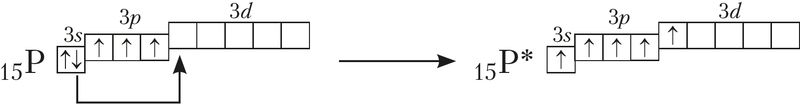
Выкарыстоўваючы аналагічныя пабудовы, можна прыйсці да высновы, што атам серы можа праяўляць валентнасці 2, 4, 6, а атам хлору — 1, 3, 5, 7.
Разгледзім валентныя магчымасці азоту, атамы якога, як і атамы фосфару, маюць пяць электронаў на знешнім электронным узроўні. Зыходзячы з электроннай канфігурацыі яго валентнага слоя 2s22p3 і электронна-графічнай схемы ![]() , робім выснову, што атамы азоту могуць праяўляць валентнасць 3, паколькі маюць тры няспараныя электроны. Пяцівалентны стан для яго немагчымы з-за адсутнасці свабодных арбіталей на другім узроўні. Аднак у атама азоту на знешнім узроўні знаходзіцца чатыры арбіталі (ячэйкі). Таму ён можа ўтварыць чатыры кавалентныя сувязі, што мы назіраем у выпадку іона амонію:
, робім выснову, што атамы азоту могуць праяўляць валентнасць 3, паколькі маюць тры няспараныя электроны. Пяцівалентны стан для яго немагчымы з-за адсутнасці свабодных арбіталей на другім узроўні. Аднак у атама азоту на знешнім узроўні знаходзіцца чатыры арбіталі (ячэйкі). Таму ён можа ўтварыць чатыры кавалентныя сувязі, што мы назіраем у выпадку іона амонію:
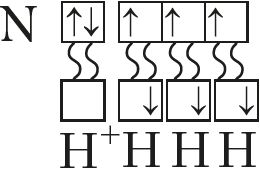
Такім чынам, максімальная валентнасць атамаў азоту роўная 4.
Максімальная валентнасць не толькі азоту, але і іншых элементаў другога перыяду не можа перавышаць чатырох, паколькі на знешняй электроннай абалонцы атамаў гэтых элементаў знаходзіцца толькі чатыры арбіталі.
Чаму нельга пашырыць валентныя магчымасці элементаў другога перыяду, даўшы электронам магчымасць перайсці на 3-і энергетычны ўзровень? Гэта тлумачыцца тым, што розніца ў энергіі паміж 2-м і 3-м энергетычнымі ўзроўнямі значна большая, чым паміж падузроўнямі аднаго энергетычнага ўзроўню, і затраты энергіі на ўзбуджэнне не кампенсуюцца энергіяй утварэння новых сувязей.
Ступень акіслення
У выпадку рэчываў з іоннымі або палярнымі сувязямі для характарыстыкі стану атамаў, што ўтвараюць гэтыя сувязі, выкарыстоўваюць паняцце ступень акіслення. Як вы ўжо ведаеце з матэрыялу параграфа § 11, ступень акіслення атама — гэта ўмоўны зарад, які прыпісваюць атаму, дапускаючы, што ён утварае з суседнімі атамамі толькі іонныя сувязі.
Колькаснае значэнне ступені акіслення атама ў канкрэтным злучэнні вызначаюць па колькасці электронаў, зрушаных пры ўтварэнні сувязі або перададзеных суседнім атамам. Так, cтупень акіслення атамаў азоту ў малекулах простага рэчыва ![]() роўная 0 (электроны не зрушаныя, сувязь кавалентная непалярная). У малекуле аміяку азот праяўляе ступень акіслення –3, паколькі да атама азоту зрушыліся тры электроны ад атамаў вадароду. Атамы вадароду пры гэтым маюць ступень акіслення +1.
роўная 0 (электроны не зрушаныя, сувязь кавалентная непалярная). У малекуле аміяку азот праяўляе ступень акіслення –3, паколькі да атама азоту зрушыліся тры электроны ад атамаў вадароду. Атамы вадароду пры гэтым маюць ступень акіслення +1.
Пры вылічэннях улічваюць, што алгебраічная сума ступеней акіслення ўсіх атамаў у злучэнні роўная 0.
Не варта забываць, што атамы некаторых элементаў маюць пастаяннае значэнне ступені акіслення ў сваіх злучэннях (,
,
,
і інш.). Найбольш электраадмоўныя атамы ў канкрэтным злучэнні звычайна маюць найніжэйшую ступень акіслення.
Так, у малекуле CF4 найбольшая электраадмоўнасць у фтору, яго атамы маюць ступень акіслення –1. Такім чынам, вуглярод знаходзіцца ў ступені акіслення +4, гэта значыць .
У перманганаце калію KMnO4 калій мае пастаянную ступень акіслення, кісларод як найбольш электраадмоўны элемент знаходзіцца ў найніжэйшай ступені акіслення –2, таму ступень акіслення марганцу можна знайсці з роўнасці 0 = (+1) + х + 4(–2), гэта значыць .
У многіх кавалентных злучэннях абсалютная велічыня ступені акіслення элементаў роўная іх валентнасці. Напрыклад, азот у малекуле аміяку мае валентнасць 3 і ступень акіслення –3. У выпадку іонных злучэнняў атамаў металаў з р-элементамі V–VII-груп выкарыстоўваюць паняцце «ступень акіслення». Напрыклад, у хларыду кальцыю СаCl2 ступень акіслення хлору –1, а кальцыю — +2.
Валентнасць можа адрознівацца ад ступені акіслення. Гэта характэрна, напрыклад, для простых рэчываў, у малекулах якіх ступень акіслення атамаў заўсёды роўная нулю, а валентнасць — ліку агульных электронных пар.
Так, у малекуле кіслароду валентнасць кіслароду роўная 2, а ступень акіслення 0. У якасці іншага прыкладу прывядзём малекулу пераксіду вадароду
. У ёй кісларод двухвалентны, а вадарод аднавалентны. У той жа час ступені акіслення абодвух элементаў па абсалютнай велічыні роўныя 1:
. Не супадаюць значэнні ступені акіслення і валентнасці азоту ў іоне амонію (–3, 4)
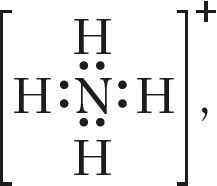 , малекуле азотнай кіслаты (+5, 4)
, малекуле азотнай кіслаты (+5, 4) .
Ступень акіслення атамаў вызначае характар магчымых хімічных узаемадзеянняў з удзелам гэтых атамаў. Так, элемент у найніжэйшай ступені акіслення (у дадзеным выпадку азот у ступені акіслення –3) можа выступаць толькі як адноўнік:
Элемент у найвышэйшай ступені акіслення (азот, +5) можа быць толькі акісляльнікам:
У прамежкавай ступені акіслення элемент (азот, +2) можа быць як акісляльнікам, так і адноўнікам:
(азот — адноўнік, акісляецца);
(азот — акісляльнік, аднаўляецца).
Найвышэйшая ступень акіслення атама А-групы роўная нумару групы (за выключэннем высакародных газаў, фтору і кіслароду). Найніжэйшая, адмоўная, ступень акіслення роўная нумару А-групы мінус 8.
Валентнасць — гэта здольнасць атамаў дадзенага элемента далучаць да сябе вызначаны лік іншых атамаў.
Валентныя магчымасці атама вызначаюцца як лікам яго няспараных электронаў у асноўным або ўзбуджаным стане, здольных прыняць удзел ва ўтварэнні хімічных сувязей па абменным механізме, так і лікам атамных арбіталей (вакантных або запоўненых) на знешнім слоі, якія ўдзельнічаюць ва ўтварэнні хімічнай сувязі па донарна-акцэптарным механізме.
Ступень акіслення атама — гэта ўмоўны зарад, які прыпісваюць атаму, дапускаючы, што ён утварае з суседнімі атамамі толькі іонныя сувязі.
Пытанні, заданні, задачы
1. Вызначце валентнасці атамаў вугляроду і кіслароду ў злучэнні, электронная формула якога ![]() . Складзіце яго структурную і малекулярную формулы.
. Складзіце яго структурную і малекулярную формулы.
2. Па электронна-графічнай формуле складзіце структурную, электронную і малекулярную формулы рэчыва. Вызначце ступені акіслення і валентнасць кожнага з атамаў. Назавіце злучэнне.
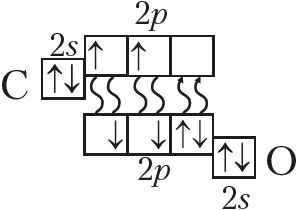
3. Назавіце значэнні найвышэйшай ступені акіслення атамаў кіслароду і серы. Чаму іх значэнні не супадаюць?
4. Адлюструйце з дапамогай электронна-графічных схем і формул электронных канфігурацый асноўны і ўзбуджаны станы атамаў S і Сl. Укажыце лік няспараных электронаў у кожным выпадку. Чаму атамы хлору часцей за ўсё праяўляюць няцотныя ступені акіслення, а атамы серы — цотныя?
5. Складзіце формулы бінарных злучэнняў, выкарыстоўваючы значэнні ступеней акіслення атамаў (табл. 7): нітрыд бору, карбід алюмінію, фасфід кальцыю, сіліцыд магнію, гідрыд натрыю, брамід жалеза(III), аксід азоту(III).
6. Вызначце ступені акіслення атамаў у іонах ,
,
,
, а таксама солях Na3РО4, Na2SO4, NaClO3, NH4Cl. Прааналізуйце атрыманыя вынікі.
7. Параўнайце ступені акіслення атамаў у кожнай пары рэчываў і зрабіце вывад — ці існуе адпаведнасць паміж аксідам і кіслатой:
- а) N2О5 и НNO2;
- б) SO3 и H2SO4;
- в) Сl2O7 и HClO4;
- г) SO2 и H2SO4.
8. Складзіце структурныя формулы, укажыце ступені акіслення кожнага атама, пакажыце стрэлкамі зрушванне электроннай шчыльнасці:
| a) |
б) |
в) |
г) |
д) |
9. Вызначце валентнасць і ступені акіслення ўсіх атамаў у злучэннях:
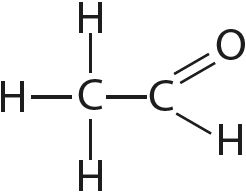
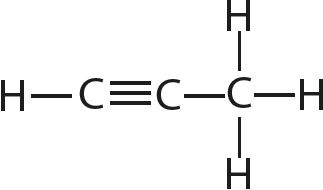
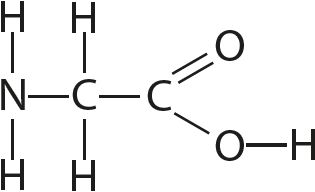
10. Вызначце ступень акіслення марганцу ў злучэнні KxMnyOz, у якім масавыя долі калію, марганцу і кіслароду адпаведна роўныя 0,396, 0,279 і 0,325.
*Самакантроль
1. Металы з пастаяннай ступенню акіслення ўваходзяць у састаў злучэнняў:
- а) FeCl3;
- б) NaClO3;
- в) K2SO4;
- г) Li2O.
2. Максімальная валентнасць не можа быць вышэйшай за чатыры ў атама:
- а) Р;
- б) Cl;
- в) S;
- г) N.
3. Валентнасць і модуль ступені акіслення вугляроду не супадаюць у злучэннях:
- а)

- б)
;
- в)
;
- г)
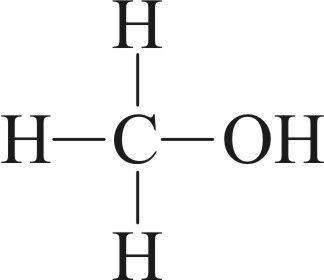 .
.
г) 4. Азот можа выступаць толькі ў якасці адноўніку ў саставе злучэнняў:
- а) N2;
- б) NH3;
- в) NH4Cl;
- г) HNO3.
5. Павелічэнне ступені акіслення хрому назіраецца ў радзе:
- а) CrCl2, Cr2O3, CrO;
- б) K2Cr2O7, K2CrO4, CrCl3;
- в) CrSO4, CrCl3, H2CrO4;
- г) CrO3, Cr2(SO4)3, CrCl2.