§ 15. Валентнасць і ступень акіслення
Валентнасць
Здольнасць атамаў далучаць да сябе строга вызначаны лік іншых атамаў характарызуецца з дапамогай валентнасці.
Найбольш проста растлумачыць, што такое валентнасць, можна на прыкладзе злучэнняў з кавалентнымі сувязямі. У такіх злучэннях валентнасць атамаў асобнага элемента прынята вызначаць лікам кавалентных сувязей, якія ўтварыліся.
Напрыклад, валентнасць кіслароду ў малекулах вады , пераксіду вадароду
, метаналю
![]() роўная двум.
роўная двум.
Валентнасць азоту ў простым рэчыве аміяку
![]() роўная тром, а ў іоне амонію — чатыром:
роўная тром, а ў іоне амонію — чатыром: 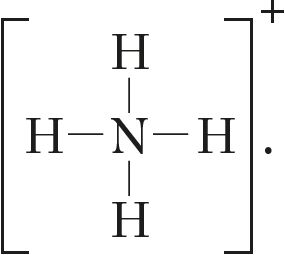
Прагназуючы лік магчымых валентнасцей атама якога-небудзь элемента ў розных злучэннях, мы ўказваем валентныя магчымасці атама. Валентныя магчымасці атама вызначаюцца:
- а) лікам няспараных валентных электронаў, здольных прыняць удзел ва ўтварэнні хімічных сувязей па абменным механізме;
- б) лікам знешніх атамных арбіталей (вакантных або запоўненых), здольных утварыць хімічную сувязь па донарна-акцэптарным механізме.
Разгледзім валентныя магчымасці атама фосфару з улікам ліку яго няспараных электронаў. Электронная канфігурацыя валентнасці слоя атама фосфару ў асноўным стане — 3s23p33d0, што дае яму магчымасць утварыць толькі тры сувязі па абменным механізме: 15P ![]()
Але атам фосфару здольны ўтварыць і пяць сувязей, калі адзін 3s-электрон перавесці ва ўзбуджаны стан. Пры гэтым электронная канфігурацыя атама фосфару будзе мець выгляд 3s13p33d1:
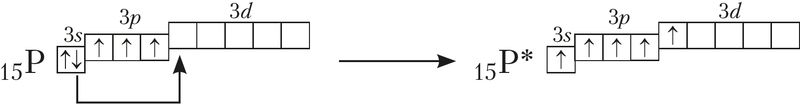
Выкарыстоўваючы аналагічныя пабудовы, можна прыйсці да высновы, што атам серы можа праяўляць валентнасці 2, 4, 6, а атам хлору — 1, 3, 5, 7.
Разгледзім валентныя магчымасці азоту, атамы якога, як і атамы фосфару, маюць пяць электронаў на знешнім электронным узроўні. Зыходзячы з электроннай канфігурацыі яго валентнага слоя 2s22p3 і электронна-графічнай схемы ![]() , робім выснову, што атамы азоту могуць праяўляць валентнасць 3, паколькі маюць тры няспараныя электроны. Пяцівалентны стан для яго немагчымы з-за адсутнасці свабодных арбіталей на другім узроўні. Аднак у атама азоту на знешнім узроўні знаходзіцца чатыры арбіталі (ячэйкі). Таму ён можа ўтварыць чатыры кавалентныя сувязі, што мы назіраем у выпадку іона амонію:
, робім выснову, што атамы азоту могуць праяўляць валентнасць 3, паколькі маюць тры няспараныя электроны. Пяцівалентны стан для яго немагчымы з-за адсутнасці свабодных арбіталей на другім узроўні. Аднак у атама азоту на знешнім узроўні знаходзіцца чатыры арбіталі (ячэйкі). Таму ён можа ўтварыць чатыры кавалентныя сувязі, што мы назіраем у выпадку іона амонію:
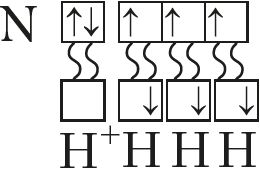
Такім чынам, максімальная валентнасць атамаў азоту роўная 4.
Максімальная валентнасць не толькі азоту, але і іншых элементаў другога перыяду не можа перавышаць чатырох, паколькі на знешняй электроннай абалонцы атамаў гэтых элементаў знаходзіцца толькі чатыры арбіталі.
Чаму нельга пашырыць валентныя магчымасці элементаў другога перыяду, даўшы электронам магчымасць перайсці на 3-і энергетычны ўзровень? Гэта тлумачыцца тым, што розніца ў энергіі паміж 2-м і 3-м энергетычнымі ўзроўнямі значна большая, чым паміж падузроўнямі аднаго энергетычнага ўзроўню, і затраты энергіі на ўзбуджэнне не кампенсуюцца энергіяй утварэння новых сувязей.