§ 11. Перыядычнасць змянення ўласцівасцей атамаў хімічных элементаў і рэчываў, якія імі ўтвораны
Перыядычнасць змянення электраадмоўнасці атамаў
У 1932 годзе Л. Полінг увёў у хімію паняцце электраадмоўнасці як меры здольнасці дадзенага атама прыцягваць да сябе электроны ад хімічна звязаных з ім іншых атамаў.
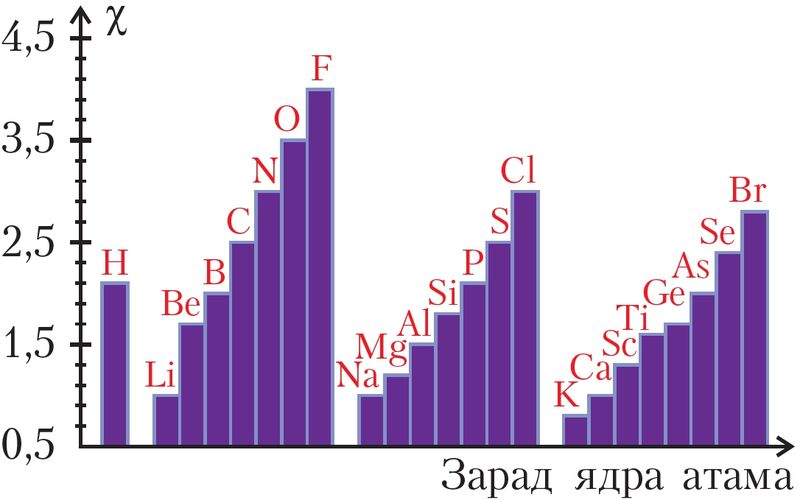
Значэнні электраадмоўнасці (χ) прыводзяцца ў даведніках (мал. 22, табл. 7). Існуе некалькі шкал і спосабаў вызначэння электраадмоўнасці. Мы будзем выкарыстоўваць шкалу Полінга.
Аналіз даных малюнка 22 указвае на перыядычны характар змянення электраадмоўнасці з ростам атамнага нумара элемента: па перыядзе яна павялічваецца, па групе — памяншаецца. Тлумачыцца гэта тым, што ў перыядзе па меры росту зараду ядра электроны мацней прыцягваюцца да ядра, у групе з ростам ліку электронных слаёў прыцягненне аслабляецца.
Да элементаў з найбольшай электраадмоўнасцю адносяцца F, O, N, Cl. Самым электраадмоўным элементам з’яўляецца фтор (χ = 4,0). Самая нізкая электраадмоўнасць у шчолачных металаў.
Табліца 7. Найбольш характэрныя ступені акіслення і электраадмоўнасці атамаў элементаў 1–3-га перыядаў
| Група | IA | IIA | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Элементы | H | He | Li | Be | B | C | N | O | F | Ne | Na | Mg | Al | Si | P | S | Cl | Ar | |
| Электраадмоўнасць | 2,2 | 1,0 | 1,6 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 0,9 | 1,3 | 1,6 | 1,9 | 2,2 | 2,6 | 3,0 | ||||
| Ступені акіслення | +7 | +7 | |||||||||||||||||
| +6 | +6 | ||||||||||||||||||
| +5 | +5 | +5 | +5 | ||||||||||||||||
| +4 | +4 | +4 | +4 | +4 | |||||||||||||||
| +3 | +3 | +3 | +3 | +3 | +3 | ||||||||||||||
| +2 | +2 | +2 | +2 | +2 | +2 | ||||||||||||||
| +1 | +1 | +1 | +1 | +1 | +1 | ||||||||||||||
| 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| –1 | –1 | –1 | –1 | –1 | |||||||||||||||
| –2 | –2 | –2 | –2 | ||||||||||||||||
| –3 | –3 | –3 | |||||||||||||||||
| –4 | –4 | –4 | |||||||||||||||||
| Формула электроннай канфігурацыі знешняга электроннага слоя | 1s1 | 1s2 | 2s1 | 2s2 | 2s22p1 | 2s22p2 | 2s22p3 | 2s22p4 | 2s22p5 | 2s22p6 | 3s1 | 3s2 | 3s23p1 | 3s23p2 | 3s23p3 | 3s23p4 | 3s23p5 | 3s23p6 | |