§ 11. Перыядычнасць змянення ўласцівасцей атамаў хімічных элементаў і рэчываў, якія імі ўтвораны
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 11. Перыядычнасць змянення ўласцівасцей атамаў хімічных элементаў і рэчываў, якія імі ўтвораны |
| Напечатано:: | Гость |
| Дата: | Понедельник, 11 Август 2025, 21:53 |
Оглавление
- Перыядычнасць змянення ўласцівасцей атамаў хімічных элементаў і рэчываў, якія імі ўтвораны
- Перыядычнасць змянення радыусаў атамаў элементаў
- Перыядычнасць змянення электраадмоўнасці атамаў
- Перыядычнасць змянення ступеней акіслення
- Перыядычнасць у змяненні ўласцівасцей простых і складаных рэчываў
- *Залежнасць уласцівасцей аксідаў і гідраксідаў ад значэння ступені акіслення элемента ў злучэнні
- Высновы
- Пытанні, заданні, задачы
- *Самакантроль
Патлумачыць і прадказаць хімічныя ўласцівасці рэчываў (металічныя і неметалічныя, акісляльна-аднаўленчыя і кіслотна-асноўныя) можна, выкарыстоўваючы звесткі аб перыядычным змяненні ўласцівасцей атамаў па меры павелічэння зараду іх ядра, найважнейшыя з якіх — радыус атама, значэнні электраадмоўнасці і ступені акіслення. Прааналізуем, як гэтыя ўласцівасці залежаць ад электроннай будовы атамаў.
Перыядычнасць змянення радыусаў атамаў элементаў
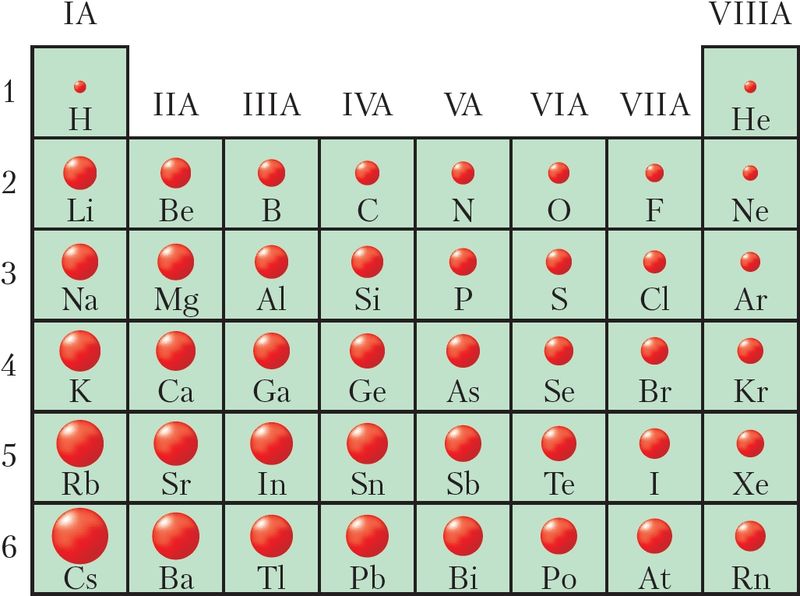
Радыус атама вызначаецца памерам яго электроннай абалонкі. З пункту гледжання верагоднасці знаходжання электрона ў каляядзернай прасторы атам не мае выразных межаў. Таму радыус атама — гэта ўмоўная велічыня. За радыус атама і перыядычны закон атама будзем прымаць адлегласць ад ядра да знешняй электроннай абалонкі, занятай электронамі. Як указана ў § 9, у сферы з такім радыусам засяроджана каля 90 % электроннай шчыльнасці.
Супаставіўшы характар змянення радыусаў атамаў (мал. 21) з іх электроннай будовай, можна зрабіць наступныя вывады:
- • у перыядзе радыусы атамаў памяншаюцца, бо з ростам зараду ядра электроны мацней прыцягваюцца да ядра;
- • у групе радыусы атамаў павялічваюцца з-за росту ліку электронных слаёў;
- • змяненне значэнняў радыусаў атамаў з ростам зараду ядра носіць перыядычны характар. У межах кожнага перыяду найбольшым радыусам валодаюць атамы шчолачных металаў, а найменшым — атамы высакародных газаў.
Значэнні радыусаў атамаў з’яўляюцца важнай характарыстыкай хімічных элементаў, паколькі яны вызначаюць сувязь знешніх, валентных, электронаў з атамам. Чым меншы радыус, тым мацней валентныя электроны ўтрымліваюцца ў атаме і наадварот.
Сілы прыцягнення або адштурхоўвання зараджаных часціц вызначаюцца законам Кулона: сіла ўзаемадзеяння двух зараджаных цел прама прапарцыйная здабытку модуляў іх зарадаў і адваротна прапарцыйная квадрату адлегласці паміж імі:
Перыядычнасць змянення электраадмоўнасці атамаў
У 1932 годзе Л. Полінг увёў у хімію паняцце электраадмоўнасці як меры здольнасці дадзенага атама прыцягваць да сябе электроны ад хімічна звязаных з ім іншых атамаў.
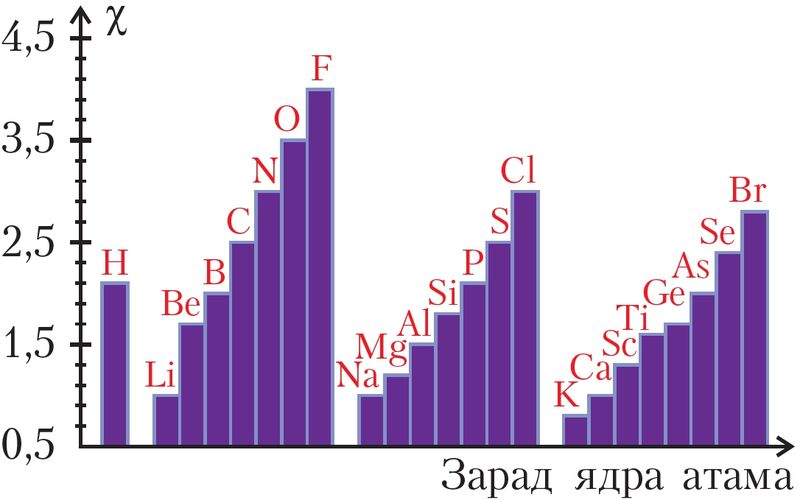
Значэнні электраадмоўнасці (χ) прыводзяцца ў даведніках (мал. 22, табл. 7). Існуе некалькі шкал і спосабаў вызначэння электраадмоўнасці. Мы будзем выкарыстоўваць шкалу Полінга.
Аналіз даных малюнка 22 указвае на перыядычны характар змянення электраадмоўнасці з ростам атамнага нумара элемента: па перыядзе яна павялічваецца, па групе — памяншаецца. Тлумачыцца гэта тым, што ў перыядзе па меры росту зараду ядра электроны мацней прыцягваюцца да ядра, у групе з ростам ліку электронных слаёў прыцягненне аслабляецца.
Да элементаў з найбольшай электраадмоўнасцю адносяцца F, O, N, Cl. Самым электраадмоўным элементам з’яўляецца фтор (χ = 4,0). Самая нізкая электраадмоўнасць у шчолачных металаў.
Табліца 7. Найбольш характэрныя ступені акіслення і электраадмоўнасці атамаў элементаў 1–3-га перыядаў
| Група | IA | IIA | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Элементы | H | He | Li | Be | B | C | N | O | F | Ne | Na | Mg | Al | Si | P | S | Cl | Ar | |
| Электраадмоўнасць | 2,2 | 1,0 | 1,6 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 0,9 | 1,3 | 1,6 | 1,9 | 2,2 | 2,6 | 3,0 | ||||
| Ступені акіслення | +7 | +7 | |||||||||||||||||
| +6 | +6 | ||||||||||||||||||
| +5 | +5 | +5 | +5 | ||||||||||||||||
| +4 | +4 | +4 | +4 | +4 | |||||||||||||||
| +3 | +3 | +3 | +3 | +3 | +3 | ||||||||||||||
| +2 | +2 | +2 | +2 | +2 | +2 | ||||||||||||||
| +1 | +1 | +1 | +1 | +1 | +1 | ||||||||||||||
| 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| –1 | –1 | –1 | –1 | –1 | |||||||||||||||
| –2 | –2 | –2 | –2 | ||||||||||||||||
| –3 | –3 | –3 | |||||||||||||||||
| –4 | –4 | –4 | |||||||||||||||||
| Формула электроннай канфігурацыі знешняга электроннага слоя | 1s1 | 1s2 | 2s1 | 2s2 | 2s22p1 | 2s22p2 | 2s22p3 | 2s22p4 | 2s22p5 | 2s22p6 | 3s1 | 3s2 | 3s23p1 | 3s23p2 | 3s23p3 | 3s23p4 | 3s23p5 | 3s23p6 | |
Перыядычнасць змянення ступеней акіслення
Нагадаем, што ступень акіслення — гэта ўмоўны зарад атама ў хімічным злучэнні, вылічаны з меркавання, што гэтае злучэнне складаецца з іонаў. Пры вызначэнні ступені акіслення лічаць, што электроны, якія ўдзельнічаюць у хімічнай сувязі, цалкам пераходзяць да больш электраадмоўнага атама. Лік далучаных атамам электронаў паказвае значэнне адмоўнай ступені акіслення, лік аддадзеных — значэнне дадатнай ступені акіслення.
Аналіз найвышэйшых і найніжэйшых ступеняў акіслення, значэнні якіх прыведзены ў табліцы 7, дазваляе зрабіць наступныя вывыды:
- • у атамаў металаў назіраюцца толькі дадатныя ступені акіслення, у неметалаў — як адмоўныя, так і дадатныя;
- • найвышэйшая дадатная ступень акіслення атама роўная максімальнаму ліку электронаў на знешняй электроннай абалонцы атама, таму яна па кожным перыядзе ўзрастае;
- • найніжэйшая адмоўная ступень акіслення атамаў неметалаў вызначаецца лікам электронаў, якія атам можа прыняць да запаўнення знешняй электроннай абалонкі, таму яна адмоўная і ў перыядзе памяншаецца па абсалютнай велічыні ад 4 (элементы IVA-групы) да 1 (элементы VIIA-групы);
- • атамы ў хімічных злучэннях могуць быць у прамежкавых ступенях акіслення; чым больш на знешнім электронным слоі электронаў, тым больш у атама магчымых ступеней акіслення і, такім чынам, больш варыянтаў магчымых хімічных злучэнняў.
Перыядычнасць у змяненні ўласцівасцей простых і складаных рэчываў
Пры дзяленні хімічных элементаў на металы і неметалы выкарыстоўваюць крытэрыі, звязаныя з уласцівасцямі простых і складаных рэчываў, якія імі ўтвараюцца (табл. 8).
Табліца 8. Адметныя прыкметы металаў і неметалаў
| Будова і ўласцівасці | Металы | Неметалы |
| Будова і ўласцівасці атамаў | Пры ўзаемадзеянні з неметаламі аддаюць ім свае электроны | Пры ўзаемадзеянні з металамі прыцягваюць да сябе іх электроны |
| На знешнім электронным слоі змяшчаецца, як правіла, 1–3 электроны | На знешнім электронным слоі змяшчаецца 4–8 электронаў, акрамя атамаў В, He і H | |
| Маюць нізкія значэнні электраадмоўнасці | Маюць высокія значэнні электраадмоўнасці | |
| Фізічныя ўласцівасці простых рэчываў | Высокая электра- і цеплаправоднасць простых рэчываў. Электраправоднасць зніжаецца з ростам тэмпературы | Цеплаізаляцыйныя ўласцівасці простых рэчываў высокія. Нізкая электраправоднасць |
| Пластычнасць простых рэчываў | Крохкасць простых рэчываў | |
| Агульныя ўласцівасці злучэнняў | У водных растворах солей пераважна існуюць у выглядзе катыёнаў | У водных растворах солей існуюць у саставе аніёнаў |
| Утвараюць пераважна асноўныя і амфатэрныя аксіды | Утвараюць кіслотныя аксіды | |
| Утвараюць моцныя і слабыя асновы | Утвараюць моцныя і слабыя кіслоты |
Праяўленне металічных уласцівасцей простымі рэчывамі звязана са здольнасцю атамаў, якія маюць нізкія значэнні электраадмоўнасці, губляць электроны. У перыядах з памяншэннем памераў атамаў электраадмоўнасць расце, слабеюць металічныя і аднаўленчыя ўласцівасці простых рэчываў. Перыяды пачынаюцца шчолачнымі металамі, а заканчваюцца неметаламі — высакароднымі газамі. У групах з павелічэннем радыусу атама электраадмоўнасць памяншаецца, узмацняюцца металічныя і аднаўленчыя ўласцівасці простых рэчываў, адпаведна, неметалічныя і акісляльныя — слабеюць.
Паслабленне металічных уласцівасцей па перыядзе выяўляецца яшчэ і ў тым, што ў аксідаў і гідраксідаў элементаў асноўныя ўласцівасці паступова слабеюць і пераходзяць у амфатэрныя, а далей нарастаюць кіслотныя ўласцівасці (табл. 9). Атамы з найбольш высокімі значэннямі электраадмоўнасці ўтвараюць кіслоты.
Табліца 9. Кіслотна-асноўныя ўласцівасці аксідаў і гідраксідаў элементаў трэцяга перыяду
| Параметры параўнання | Група | ||||||
| I | II | III | IV | V | VI | VII | |
| Найвышэйшая ступень акіслення | +1 | +2 | +3 | +4 | +5 | +6 | +7 |
| Вышэйшы аксід і яго ўласцівасці | Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
| Асноўныя аксіды | Амфатэрны аксід | Кіслотныя аксіды | |||||
| Гідраксід і яго ўласцівасці | NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
| Асновы | Амфатэрны гідраксід | Вельмі слабая кіслата | Слабая кіслата | Моцная кіслата | Вельмі моцная кіслата | ||
| Вадародныя злучэнні (гідрыды) | NaH | MgH2 | AlH3 | SiH4 | PH3 | H2S | HCl |
| Нелятучыя вадародныя злучэнні металаў | Лятучыя вадародныя злучэнні неметалаў | ||||||
Пры аднолькавым значэнні ступеней акіслення атамаў асноўныя ўласцівасці гідраксідаў (і аксідаў) узрастаюць з павелічэннем памеру атамаў і памяншэннем іх электраадмоўнасці, бо аслабляецца ўзаемадзеянне катыёнаў металаў з гідраксід-іонамі. Таму сіла асноў узрастае па групах перыядычнай сістэмы.
У групах з павелічэннем радыусаў атамаў элементаў кіслотныя ўласцівасці аксідаў і гідраксідаў паступова слабеюць (табл. 10).
Табліца 10. Кіслотна-асноўныя ўласцівасці аксідаў і гідраксідаў некаторых элементаў IIA-групы
| Перыяд | Група IIA | ||
| Элемент | Вышэйшы аксід і яго ўласцівасці | Гідраксід і яго ўласцівасці | |
| 2 | Be | ВеО — амфатэрны аксід | Be(OH)2 — амфатэрны гідраксід |
| 3 | Mg | MgO — асноўны аксід | Mg(OH)2 — аснова |
| 4 | Ca | CaO — асноўны аксід | Ca(OH)2 — моцная аснова |
| 5 | Sr | SrO — асноўны аксід | Sr(OH)2 — моцная аснова |
Варта адзначыць, што вадародныя злучэнні металаў — цвёрдыя рэчывы, а неметалаў — як правіла, газападобныя рэчывы.
*Залежнасць уласцівасцей аксідаў і гідраксідаў ад значэння ступені акіслення элемента ў злучэнні
Ступень акіслення атамаў, якія ўтвараюць аксіды і гідраксіды, уплывае на характар уласцівасцей гэтых рэчываў.
Напрыклад, у радзе аксідаў з павелічэннем ступені акіслення атамаў элемента адбываецца паслабленне асноўных і нарастанне кіслотных уласцівасцей. Так, у Li2O выражаны асноўныя ўласцівасці, у BeO — ужо амфатэрныя, у астатніх аксідаў — кіслотныя, прычым сіла кіслотных уласцівасцей нарастае з павелічэннем ступені акіслення ў радзе
.
Аналагічная заканамернасць назіраецца і для адпаведных гэтым аксідам гідраксідаў: LiOH — моцная аснова; Be(OH)2 — амфатэрны гідраксід; Н3ВО3 або B(OH)3 і H2CO3 — слабыя кіслоты; HNO3 — моцная кіслата.
| Аксiды | |||||
| Гiдраксiды | |||||
| Расце ступень акіслення, змяншаецца радыус атама элемента | |||||
| Нарастаюць кіслотныя ўласцівасці | |||||
| Слабеюць асноўныя ўласцівасці | |||||
Узмацненне кіслотных уласцівасцей аксідаў і гідраксідаў з павелічэннем значэння ступені акіслення элемента ў злучэнні назіраецца і для асобных элементаў. Так, змену ўласцівасцей у радзе кіслародзмяшчальных кіслот хлору можна паказаць наступнай схемай:
| Расце ступень акіслення атама хлору | |||
| Узмацняюцца кіслотныя ўласцівасці, павышаецца ўстойлівасць злучэнняў | |||
| Узмацняецца акісляльная здольнасць | |||
Такім чынам, з павелічэннем значэння ступені акіслення хлору ўстойлівасць яго гідраксідаў (кіслот) расце, а іх акісляльная здольнасць памяншаецца. Найбольш моцным акісляльнікам з’яўляецца хларнавацістая кіслата (HClO), а найменш моцным — хлорная кіслата (HClO4).
Такая самая заканамернасць — узмацненне кіслотных уласцівасцей гідраксіду (і, адпаведна, паслабленне яго асноўных уласцівасцей) — з ростам ступені акіслення элемента характэрная не толькі для хлору, але і для іншых элементаў. Найбольш ярка гэтая заканамернасць прасочваецца ў аксідах і гідраксідах хрому і марганцу, што мы спецыяльна разгледзім у § 49.1.
З павелічэннем зараду атамных ядраў адбываецца перыядычнае змяненне:
- • уласцівасцей атамаў (радыусаў, электраадмоўнасці, ступеней акіслення);
- • уласцівасцей простых рэчываў, якія ўтвораны элементамі (металічных і неметалічных, акісляльных і аднаўленчых);
- • уласцівасцей складаных рэчываў (акісляльна-аднаўленчых і кіслотна-асноўных уласцівасцей аксідаў, гідраксідаў, а таксама вадародных злучэнняў).
Пытанні, заданні, задачы
1. Расстаўце ў парадку ўзрастання атамных радыусаў элементы: Cl, N, Si, He, Li, Al. Дайце тлумачэнне.
2. Растлумачце, чаму атамны радыус пры пераходзе:
- а) ад алюмінію да крэмнію памяншаецца;
- б) ад неону да натрыю рэзка павялічваецца.
3. Выкарыстоўваючы заканамернасці ў змяненні атамных радыусаў, растлумачце змяненне электраадмоўнасці атамаў у радзе элементаў:
- а) F, Cl, Br, I;
- б) S, P, Si.
4. Вам вядома, што падабенства ўласцівасцей элементаў адной і той жа групы тлумачыцца аднолькавым лікам валентных электронаў. Пакажыце, чым абумоўлена адрозненне ўласцівасцей элементаў адной групы.
5. Пакажыце максімальныя і мінімальныя ступені акіслення атамаў: Ca, Cl, K, Na, Mg, Si, P.
6. Намалюйце ў сшытку і запоўніце табліцу «Змяненне ўласцівасцей атамаў і іх злучэнняў па перыядах і групах».
| Уласцівасці | Характар змяненняў пры руху ў табліцы | |
| Па перыядзе |
Па групе |
|
| Зарад ядра атама | ||
| Лік электронных слаёў у атаме | ||
| Лік электронаў на знешнім слоі атама | ||
| Радыус атама | ||
| Электраадмоўнасць | ||
| Здольнасць прыцягваць электроны | ||
| Здольнасць аддаваць электроны | ||
| Металічныя ўласцівасці простых рэчываў | ||
| Неметалічныя ўласцівасці простых рэчываў | ||
| Асноўныя ўласцівасці аксідаў і гідраксідаў элементаў | ||
| Кіслотныя ўласцівасці аксідаў і гідраксідаў | ||
7. З прапанаванага пераліку характарыстык выберыце тыя, якія лінейна (а не перыядычна) змяняюцца з ростам зараду ядра атама: электраадмоўнасць, лік пратонаў, радыус атама, маса атама, агульная колькасць электронаў, лік электронаў на знешнім слоі, ступень акіслення.
8. Для азоту характэрны наступныя ступені акіслення: +5, +4, +3, +2, +1, 0, –1, –2, –3. Якія ўласцівасці — акісляльныя або аднаўленчыя — выражаны ў кожнай з гэтых ступеней акіслення азоту?
9. Зыходзячы са становішча элементаў N, P, C, Al, S у перыядычнай сістэме, параўнайце кіслотныя ўласцівасці:
- а) HNO3 и H3PO4;
- б) Al(OH)3 и H3PO4;
- в) H3PO4 и H2SO4.
10. Масы двух вадародных злучэнняў роўныя. Параўнайце колькасна іх аб’ёмы пры н. у., калі вядома, што абодва злучэнні газападобныя і ўтвораны элементамі з канфігурацыяй [Ne]3s23p5 і [He]2s22p3.
*Самакантроль
1. Састаў найвышэйшых аксідаў выражаецца агульнай формулай ЭО3 для элементаў:
- а) С;
- б) S;
- в) Se;
- г) Cr.
2. Электраадмоўнасць элементаў узрастае ў радах:
- а) С, F, Cl;
- б) S, Cl, F;
- в) S, O, F;
- г) C, O, N.
3. Асноўныя ўласцівасці рэчываў спачатку ўзрастаюць, а потым змяншаюцца ў радах:
- а) MgO, BeO, Li2O;
- б) Al(ОН)3, Mg(ОН)2, Be(ОН)2;
- в) ZnO, K2O, CuO;
- г) LiОН, NaОН, Mg(OН)2.
4. Металічныя ўласцівасці ў першага простага рэчыва выражаны мацней, чым у другога, у пары:
- а) Са і K;
- б) Ва і Ra;
- в) Li і Ве;
- г) Fe і Ca.
5. Кіслотныя ўласцівасці найбольш моцна выражаны ў гідраксіду:
- а) Н2СО3;
- б) Н2SiО3;
- в) Al(ОН)3;
- г) НСlО4.