§ 11. Перыядычнасць змянення ўласцівасцей атамаў хімічных элементаў і рэчываў, якія імі ўтвораны
Перыядычнасць змянення радыусаў атамаў элементаў
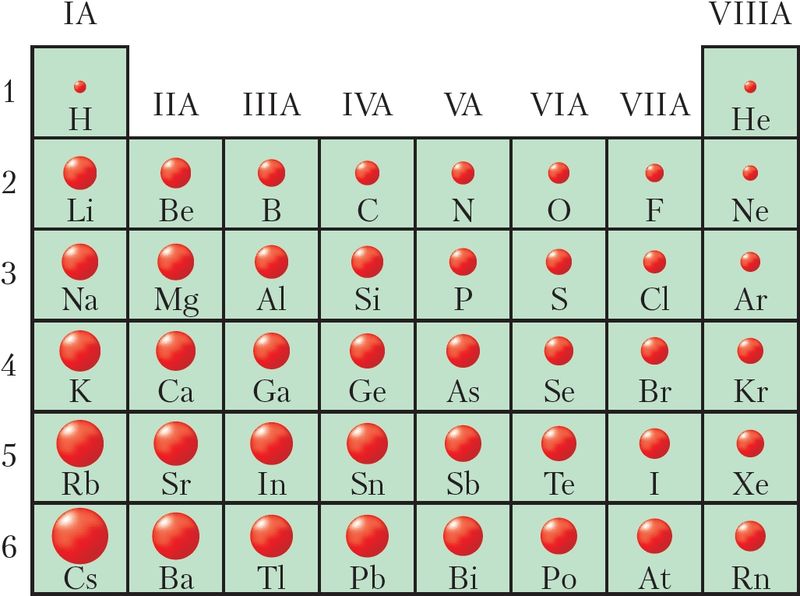
Радыус атама вызначаецца памерам яго электроннай абалонкі. З пункту гледжання верагоднасці знаходжання электрона ў каляядзернай прасторы атам не мае выразных межаў. Таму радыус атама — гэта ўмоўная велічыня. За радыус атама і перыядычны закон атама будзем прымаць адлегласць ад ядра да знешняй электроннай абалонкі, занятай электронамі. Як указана ў § 9, у сферы з такім радыусам засяроджана каля 90 % электроннай шчыльнасці.
Супаставіўшы характар змянення радыусаў атамаў (мал. 21) з іх электроннай будовай, можна зрабіць наступныя вывады:
- • у перыядзе радыусы атамаў памяншаюцца, бо з ростам зараду ядра электроны мацней прыцягваюцца да ядра;
- • у групе радыусы атамаў павялічваюцца з-за росту ліку электронных слаёў;
- • змяненне значэнняў радыусаў атамаў з ростам зараду ядра носіць перыядычны характар. У межах кожнага перыяду найбольшым радыусам валодаюць атамы шчолачных металаў, а найменшым — атамы высакародных газаў.
Значэнні радыусаў атамаў з’яўляюцца важнай характарыстыкай хімічных элементаў, паколькі яны вызначаюць сувязь знешніх, валентных, электронаў з атамам. Чым меншы радыус, тым мацней валентныя электроны ўтрымліваюцца ў атаме і наадварот.
Сілы прыцягнення або адштурхоўвання зараджаных часціц вызначаюцца законам Кулона: сіла ўзаемадзеяння двух зараджаных цел прама прапарцыйная здабытку модуляў іх зарадаў і адваротна прапарцыйная квадрату адлегласці паміж імі: