§ 10. Перыядычны закон у святле тэорыі будовы атама
Пытанні, заданні, задачы
1. Патлумачце на прыкладзе азоту фізічны сэнс парадкавага нумара хімічнага элемента, нумара А-групы, нумара перыяду.
2. Чаму элементы IА- і IIА-груп называюць s-элементамі, а элементы IIIА- і VIIIА-групп — p-элементамі?
3. Пабудуйце электронна-графічныя схемы і запішыце электронныя формулы атамаў хімічных элементаў 3-га перыяду.
4. Чаму ўласцівасці хімічных элементаў і іх злучэнняў падпарадкоўваюцца перыядычнаму закону? Абгрунтуйце свой адказ.
5. Чаму элементы адной групы праяўляюць падабенства ва ўласцівасцях? У чым прычына адрознення ўласцівасцей хімічных элементаў, размешчаных у адной групе?
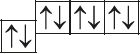
6. Прааналізуйце прыведзеныя электронна-графічныя схемы, адзначце, якія станы атама з’яўляюцца асноўнымі, а якія ўзбуджанымі:
- а)
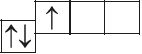
- б)
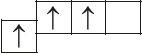
- в)
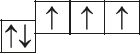
- г)
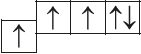
- д)
7. Вызначце лік энергетычных узроўняў, на якіх у атамах кіслароду, магнію, кальцыю і свінцу ў асноўным стане размешчаны электроны.
8. Укажыце:
- а) лік электронаў на знешняй электроннай абалонцы ў атамах хімічных элементаў з парадкавымі нумарамі 5, 15, 20, 32, 53;
- б) сімвалы элементаў, у атамах якіх цалкам запоўнены знешнія электронныя абалонкі.
9. Вызначце масу солі, атрыманай пры растварэнні ў кіслаце саставу НЭ металу Ме масай 5 г. Пры гэтым вядома, што элемент, які ўваходзіць у састаў кіслаты мае электронную канфігурацыю [Ne]3s23p5, а электронная схема металу 2е–, 8е–, 2е–.
10. Складзіце электронна-графічную схему атама хімічнага элемента Э, злучэнні якога шырока выкарыстоўваюцца ў сельскай гаспадарцы. Адно з іх мае састаў (ЭН2)2СО, а масавая доля элемента ў ім роўная 46,67 %.