§ 10. Перыядычны закон у святле тэорыі будовы атама

У ходзе карпатлівай працы па сістэматызацыі ўласцівасцей простых і складаных рэчываў прафесар Санкт-Пецярбургскага ўніверсітэта Д. І. Мендзялееў выявіў перыядычную залежнасць саставу вышэйшых аксідаў і вадародных злучэнняў хімічных элементаў ад іх атамнай масы. Размясціўшы сімвалы хімічных элементаў у парадку ўзрастання атамнай масы і аб’яднаўшы элементы з аднолькавай формулай вышэйшага аксіду ў групы, у 1869 годзе Д. І. Мендзялееў стварыў табліцу, якую назваў перыядычнай. Аказалася, што элементы, аб’яднаныя ў адну групу па прыкмеце агульнай валентнасці, маюць блізкія хімічныя ўласцівасці. На аснове ўстаноўленай заканамернасці ён сфармуляваў закон, які атрымаў назву перыядычнага.
У адрозненне ад фізічных законаў, якія звычайна падаюцца ў выглядзе формул, перыядычны закон быў паказаны Д. І. Мендзялеевым у выглядзе перыядычнай сістэмы хімічных элементаў.
У 1913 годзе было эксперыментальна ўстаноўлена, што хімічны элемент — гэта від атамаў з пэўным дадатным зарадам ядра, значэнне якога адпавядае парадкаваму нумару хімічнага элемента ў перыядычнай сістэме. Пасля гэтага перыядычны закон атрымаў новую фармулёўку:
уласцівасці атамаў хімічных элементаў, а таксама састаў і ўласцівасці рэчываў, утвораных імі, знаходзяцца ў перыядычнай залежнасці ад зараду атамных ядраў.
Такім чынам, парадкавы нумар хімічнага элемента набыў фізічны сэнс. Як вы ўжо ведаеце, калі за адзінку вымярэння зараду прыняць зарад электрона, то адносны зарад ядра любога атама будзе колькасна роўны парадкаваму нумару Z адпаведнага хімічнага элемента.
Наступным этапам развіцця тэорыі перыядычнай сістэмы стала высвятленне прычыны перыядычнай залежнасці ўласцівасцей хімічных элементаў ад зараду ядра атамаў, абгрунтаванне інтэрвалаў перыядычнасці.
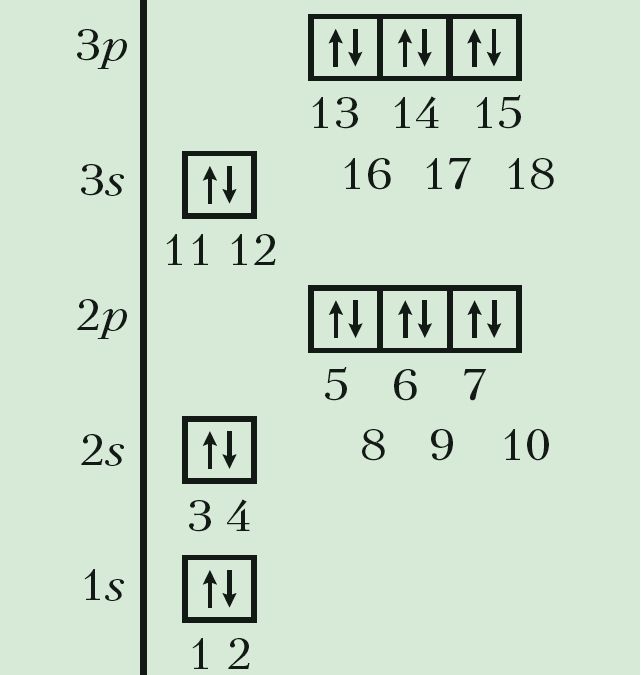
Для высвятлення гэтых прычын давайце прасочым, як па меры ўзрастання зараду атамных ядраў змяняюцца станы электронаў у атамах хімічных элементаў. Для кожнага элемента запішам формулу электроннай канфігурацыі і пабудуем электронна-графічную схему ў адпаведнасці з малюнкам 20.
Пры вырашэнні пытання аб паслядоўнасці запаўнення электронамі атамных арбіталей будзем кіравацца наступнымі правіламі.
1. Электроны ў атаме ў першую чаргу запаўняюць свабодныя атамныя арбіталі з найбольш нізкай энергіяй. Энергія атамных арбіталей узрастае ў наступнай паслядоўнасці:
1s < 2s <2p < 3s < 3p <4s < 3d < 4p…
2. На адной атамнай арбіталі можа знаходзіцца не больш за два электроны, прычым электроны павінны мець антыпаралельныя спіны.
3. Лік няспараных электронаў на дадзеным энергетычным падузроўні павінен быць максімальным.
Стан атама, у якога атамныя арбіталі запоўнены электронамі ў названай паслядоўнасці, з’яўляецца асноўным станам, гэта значыць станам з найменшай энергіяй. Усе астатнія станы будуць узбуджанымі.
Такім чынам, у атама вадароду з адносным зарадам ядра Z = 1 адзіны электрон павінен заняць самую нізкую па энергіі атамную арбіталь 1s. У атама наступнага элемента абодва электроны засяляюць тую ж 1s-арбіталь, але павінны мець супрацьлеглыя спіны:
Паколькі на першым энергетычным узроўні ёсць толькі адна атамная арбіталь, якая не можа змясціць больш за два электроны, то трэці і чацвёрты электроны ў атамах з Z = 3 і Z = 4 займаюць наступную па энергіі 2s-арбіталь. Атамы гэтых элементаў пачынаюць другі перыяд:
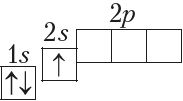
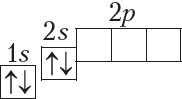
У атамах наступных элементаў электроны запаўняюць 2p-падузровень: спачатку па адным электроне на кожную з трох р-арбіталей; затым, пачынаючы з атама кіслароду (Z = 6), кожная р-арбіталь запаўняецца другім электронам:
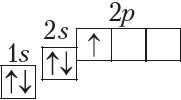
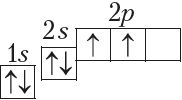
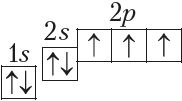
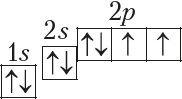
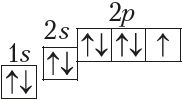
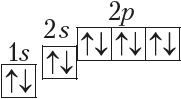
Паколькі другі энергетычны ўзровень не можа ўтрымліваць больш за 8 электронаў, то элемент з адносным зарадам ядра атама +11 (Z = 11) пачынае трэці перыяд:
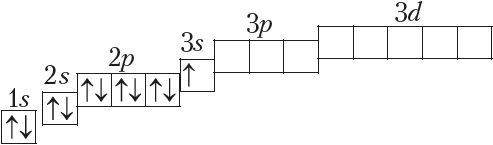
Паслядоўнасць запаўнення электронамі атамных арбіталей на трэцім энергетычным узроўні аналагічная той, што мы назіралі для другога ўзроўню (Дадатак 1). Стан электронаў апошняга элемента трэцяга перыяду аргону (Z = 18) апісваецца так:
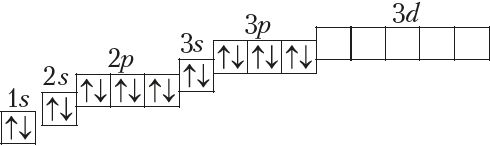
Пры гэтым у атама Ar, у адрозненне ад атамаў папярэдніх высакародных газаў He і Ne, запаўненне электронамі трэцяга энергетычнага ўзроўню не заканчваецца. У яго застаюцца незапоўненымі 3d-арбіталі. Паколькі на знешнім электронным слоі не можа быць больш за 8 электронаў, то наступны за аргонам элемент (Z = 19) пачынае новы, чацвёрты перыяд.
Для кампактнасці запісу запоўненыя электронныя воблакі ў формулах электронных канфігурацый заменім сімвалам высакароднага газу, атам якога мае такую ж электронную канфігурацыю. Так, запіс 1s2 можна замяніць на [He], 1s22s22p6 — на [Ne], 1s22s22p63s23p6 — на [Ar] і г. д. Напрыклад, формулу электроннай канфігурацыі атама літыю можна запісаць як [He]2s1, хлору — [Ne]3s23p5.
На гэтым спынім разгляд электронных канфігурацый атамаў хімічных элементаў.
Супаставіўшы формулы электронных канфігурацый атамаў са становішчам адпаведных ім хімічных элементаў у перыядычнай сістэме, можна звярнуць увагу на наступныя заканамернасці.
Па-першае, пачатак кожнага перыяду супадае з пачаткам запаўнення новага энергетычнага ўзроўню ў атаме. Значэнне нумара гэтага ўзроўню (n) роўнае нумару перыяду. У гэтым заключаецца фізічны сэнс нумара перыяду.
Па-другое, лік электронаў на знешняй электроннай абалонцы атама А-групы роўны нумару групы, у якой размешчаны адпаведны гэтаму атаму хімічны элемент. У гэтым заключаецца фізічны сэнс нумара групы. Максімальны лік электронаў на знешняй электроннай абалонцы атамаў не перавышае васьмі (табл. 6).
Табліца 6. Электронная канфігурацыя атамаў хімічных элементаў А-груп
| Параметры параўнання | Групы | |||||||
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Знешняя абалонка | ns1 | ns2 | ns2np1 | ns2np2 | ns2np3 | ns2np4 | ns2np5 | ns2np6 |
| Лік e– на знешняй абалонцы | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Вышэйшы аксід | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | — |
| Вадароднае злучэнне | RH | RH2 | RH3 | RH4 | RH3 | RH2 | RH | — |
Трэцяя заканамернасць вынікае з аналізу наступнай лагічнай схемы, якую мы пабудуем з улікам ведаў, атрыманых у 8–10-х класах.
Чацвёртую заканамернасць нам дазволіць вывесці лагічная схема.
Праведзенае супастаўленне дазваляе зрабіць вывад: уласцівасці хімічных элементаў змяняюцца перыядычна таму, што перыядычна змяняецца электронная канфігурацыя знешняй электроннай абалонкі іх атамаў.