§ 10. Перыядычны закон у святле тэорыі будовы атама
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 10. Перыядычны закон у святле тэорыі будовы атама |
| Напечатано:: | Гость |
| Дата: | Monday, 20 October 2025, 19:04 |

У ходзе карпатлівай працы па сістэматызацыі ўласцівасцей простых і складаных рэчываў прафесар Санкт-Пецярбургскага ўніверсітэта Д. І. Мендзялееў выявіў перыядычную залежнасць саставу вышэйшых аксідаў і вадародных злучэнняў хімічных элементаў ад іх атамнай масы. Размясціўшы сімвалы хімічных элементаў у парадку ўзрастання атамнай масы і аб’яднаўшы элементы з аднолькавай формулай вышэйшага аксіду ў групы, у 1869 годзе Д. І. Мендзялееў стварыў табліцу, якую назваў перыядычнай. Аказалася, што элементы, аб’яднаныя ў адну групу па прыкмеце агульнай валентнасці, маюць блізкія хімічныя ўласцівасці. На аснове ўстаноўленай заканамернасці ён сфармуляваў закон, які атрымаў назву перыядычнага.
У адрозненне ад фізічных законаў, якія звычайна падаюцца ў выглядзе формул, перыядычны закон быў паказаны Д. І. Мендзялеевым у выглядзе перыядычнай сістэмы хімічных элементаў.
У 1913 годзе было эксперыментальна ўстаноўлена, што хімічны элемент — гэта від атамаў з пэўным дадатным зарадам ядра, значэнне якога адпавядае парадкаваму нумару хімічнага элемента ў перыядычнай сістэме. Пасля гэтага перыядычны закон атрымаў новую фармулёўку:
уласцівасці атамаў хімічных элементаў, а таксама састаў і ўласцівасці рэчываў, утвораных імі, знаходзяцца ў перыядычнай залежнасці ад зараду атамных ядраў.
Такім чынам, парадкавы нумар хімічнага элемента набыў фізічны сэнс. Як вы ўжо ведаеце, калі за адзінку вымярэння зараду прыняць зарад электрона, то адносны зарад ядра любога атама будзе колькасна роўны парадкаваму нумару Z адпаведнага хімічнага элемента.
Наступным этапам развіцця тэорыі перыядычнай сістэмы стала высвятленне прычыны перыядычнай залежнасці ўласцівасцей хімічных элементаў ад зараду ядра атамаў, абгрунтаванне інтэрвалаў перыядычнасці.
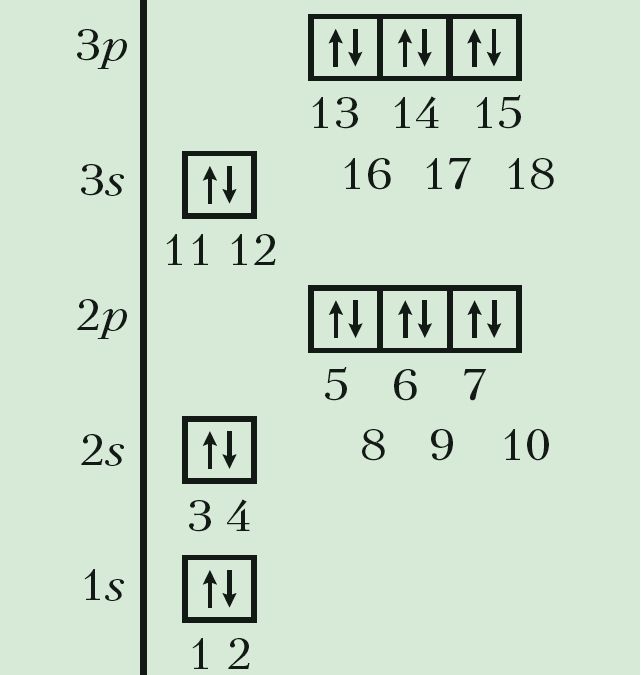
Для высвятлення гэтых прычын давайце прасочым, як па меры ўзрастання зараду атамных ядраў змяняюцца станы электронаў у атамах хімічных элементаў. Для кожнага элемента запішам формулу электроннай канфігурацыі і пабудуем электронна-графічную схему ў адпаведнасці з малюнкам 20.
Пры вырашэнні пытання аб паслядоўнасці запаўнення электронамі атамных арбіталей будзем кіравацца наступнымі правіламі.
1. Электроны ў атаме ў першую чаргу запаўняюць свабодныя атамныя арбіталі з найбольш нізкай энергіяй. Энергія атамных арбіталей узрастае ў наступнай паслядоўнасці:
1s < 2s <2p < 3s < 3p <4s < 3d < 4p…
2. На адной атамнай арбіталі можа знаходзіцца не больш за два электроны, прычым электроны павінны мець антыпаралельныя спіны.
3. Лік няспараных электронаў на дадзеным энергетычным падузроўні павінен быць максімальным.
Стан атама, у якога атамныя арбіталі запоўнены электронамі ў названай паслядоўнасці, з’яўляецца асноўным станам, гэта значыць станам з найменшай энергіяй. Усе астатнія станы будуць узбуджанымі.
Такім чынам, у атама вадароду з адносным зарадам ядра Z = 1 адзіны электрон павінен заняць самую нізкую па энергіі атамную арбіталь 1s. У атама наступнага элемента абодва электроны засяляюць тую ж 1s-арбіталь, але павінны мець супрацьлеглыя спіны:
Паколькі на першым энергетычным узроўні ёсць толькі адна атамная арбіталь, якая не можа змясціць больш за два электроны, то трэці і чацвёрты электроны ў атамах з Z = 3 і Z = 4 займаюць наступную па энергіі 2s-арбіталь. Атамы гэтых элементаў пачынаюць другі перыяд:
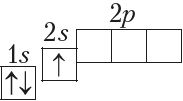
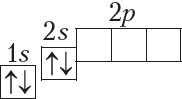
У атамах наступных элементаў электроны запаўняюць 2p-падузровень: спачатку па адным электроне на кожную з трох р-арбіталей; затым, пачынаючы з атама кіслароду (Z = 6), кожная р-арбіталь запаўняецца другім электронам:
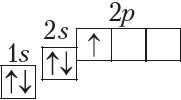
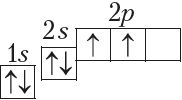
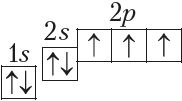
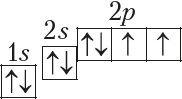
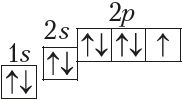
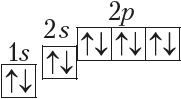
Паколькі другі энергетычны ўзровень не можа ўтрымліваць больш за 8 электронаў, то элемент з адносным зарадам ядра атама +11 (Z = 11) пачынае трэці перыяд:
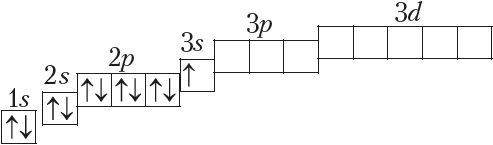
Паслядоўнасць запаўнення электронамі атамных арбіталей на трэцім энергетычным узроўні аналагічная той, што мы назіралі для другога ўзроўню (Дадатак 1). Стан электронаў апошняга элемента трэцяга перыяду аргону (Z = 18) апісваецца так:
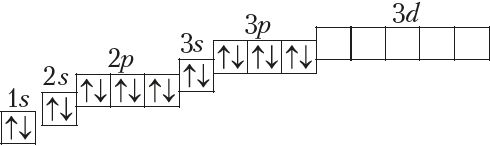
Пры гэтым у атама Ar, у адрозненне ад атамаў папярэдніх высакародных газаў He і Ne, запаўненне электронамі трэцяга энергетычнага ўзроўню не заканчваецца. У яго застаюцца незапоўненымі 3d-арбіталі. Паколькі на знешнім электронным слоі не можа быць больш за 8 электронаў, то наступны за аргонам элемент (Z = 19) пачынае новы, чацвёрты перыяд.
Для кампактнасці запісу запоўненыя электронныя воблакі ў формулах электронных канфігурацый заменім сімвалам высакароднага газу, атам якога мае такую ж электронную канфігурацыю. Так, запіс 1s2 можна замяніць на [He], 1s22s22p6 — на [Ne], 1s22s22p63s23p6 — на [Ar] і г. д. Напрыклад, формулу электроннай канфігурацыі атама літыю можна запісаць як [He]2s1, хлору — [Ne]3s23p5.
На гэтым спынім разгляд электронных канфігурацый атамаў хімічных элементаў.
Супаставіўшы формулы электронных канфігурацый атамаў са становішчам адпаведных ім хімічных элементаў у перыядычнай сістэме, можна звярнуць увагу на наступныя заканамернасці.
Па-першае, пачатак кожнага перыяду супадае з пачаткам запаўнення новага энергетычнага ўзроўню ў атаме. Значэнне нумара гэтага ўзроўню (n) роўнае нумару перыяду. У гэтым заключаецца фізічны сэнс нумара перыяду.
Па-другое, лік электронаў на знешняй электроннай абалонцы атама А-групы роўны нумару групы, у якой размешчаны адпаведны гэтаму атаму хімічны элемент. У гэтым заключаецца фізічны сэнс нумара групы. Максімальны лік электронаў на знешняй электроннай абалонцы атамаў не перавышае васьмі (табл. 6).
Табліца 6. Электронная канфігурацыя атамаў хімічных элементаў А-груп
| Параметры параўнання | Групы | |||||||
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Знешняя абалонка | ns1 | ns2 | ns2np1 | ns2np2 | ns2np3 | ns2np4 | ns2np5 | ns2np6 |
| Лік e– на знешняй абалонцы | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Вышэйшы аксід | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | — |
| Вадароднае злучэнне | RH | RH2 | RH3 | RH4 | RH3 | RH2 | RH | — |
Трэцяя заканамернасць вынікае з аналізу наступнай лагічнай схемы, якую мы пабудуем з улікам ведаў, атрыманых у 8–10-х класах.
Чацвёртую заканамернасць нам дазволіць вывесці лагічная схема.
Праведзенае супастаўленне дазваляе зрабіць вывад: уласцівасці хімічных элементаў змяняюцца перыядычна таму, што перыядычна змяняецца электронная канфігурацыя знешняй электроннай абалонкі іх атамаў.
*Электронныя канфігурацыі атамаў элементаў чацвёртага перыяду
Паводле схемы размеркавання атамных арбіталей па энергіі, як на малюнку 18, энергія 3d-арбіталей вышэйшая, чым 4s-арбіталей, таму ў атаме калію апошні электрон займае больш нізкую па энергіі 4s-арбіталь з утварэннем электроннай канфігурацыі 1s22s22p63s23p64s1. Аналагічна адбываецца і з апошнімі двума электронамі атама кальцыю. Пры гэтым фарміруецца электронная канфігурацыя 1s22s22p63s23p64s2.
У атамаў элементаў, якія ідуць за кальцыем у 4-м перыядзе, энергетычна больш пажадана запаўненне электронамі не 4p-, а 3d-падузроўню.
Прынцып запаўнення электронамі 3d-арбіталей той самы, што для s- і p-арбіталей: па меры назапашвання электроны па чарзе запаўняюць 3d-арбіталі спачатку па адным электроне, пасля запаўнення ўсіх арбіталей — па другім. Так, электронная канфігурацыя атама жалеза з шасцю электронамі на 3d-падузроўні апісваецца формулай 1s22s22p63s23p63d64s2.
Парушаецца парадак запаўнення электронамі атамных арбіталей у атамах хрому і медзі. Для іх энергетычна больш устойлівыя станы з адным электронам на 4s-арбіталі: Cr — 1s22s22p63s23p63d54s1, Cu — 1s22s22p63s23p63d104s1.
Электроны ў атаме цынку завяршаюць запаўненне 3d-падузроўню, і ў наступнага за ім элемента галію пачынае запаўняцца наступны па ўзрастанні энергіі 4p-падузровень. Запаўненне гэтага падузроўню заканчваецца ў атама высакароднага газу крыптону. Формула электроннай канфігурацыі Kr — 1s22s22p63s23p63d104s24p6.
Паколькі ў атамаў ад скандыю да цынку адбываецца паслядоўнае запаўненне электронамі 3d-падузроўняў, іх называюць d-элементамі. З прычыны таго, што існуе пяць d-арбіталей, у 4-м і кожным наступным перыядзе ёсць па дзесяць d-элементаў. Формулы электронных канфігурацый для d-элементаў 4-га перыяду прыведзены ў табліцы 5.1.
Табліца 5.1. Электронныя канфігурацыі атамаў элементаў 4-га перыяду
| Электронная схема | Формула электроннай канфігурацыі |
| 19K 2e–, 8e–, 8e–, 1e– | 19K 1s22s22p63s23p64s1 |
| 20Са 2e–, 8e–, 8e–, 2e– | 20Са 1s22s22p63s23p64s2 |
| 21Sc 2e–, 8e–, 9e–, 2e– | 21Sc 1s22s22p63s23p63d14s2 |
| 22Тi 2e–, 8e–, 10e–, 2e– | 22Тi 1s22s22p63s23p63d24s2 |
| 23V 2e–, 8e–, 11e–, 2e– | 23V 1s22s22p63s23p63d34s2 |
| 24Cr 2e–, 8e–, 13e–, 1e– | 24Cr 1s22s22p63s23p63d54s1 |
| 25Mn 2e–, 8e–, 13e–, 2e– | 25Mn 1s22s22p63s23p63d54s2 |
| 26Fe 2e–, 8e–, 14e–, 2e– | 26Fe 1s22s22p63s23p63d64s2 |
| 27Co 2e–, 8e–, 15e–, 2e– | 27Co 1s22s22p63s23p63d74s2 |
| 28Ni 2e–, 8e–, 16e–, 2e– | 28Ni 1s22s22p63s23p63d84s2 |
| 29Cu 2e–, 8e–, 18e–, 1e– | 29Cu 1s22s22p63s23p63d104s1 |
| 30Zn 2e–, 8e–, 18e–, 2e– | 30Zn 1s22s22p63s23p63d104s2 |
| 31Ga 2e–, 8e–, 18e–, 3e– | 31Ga 1s22s22p63s23p63d104s24р1 |
| 32Ge 2e–, 8e–, 18e–, 4e– | 32Ge 1s22s22p63s23p63d104s24р2 |
| 33As 2e–, 8e–, 18e–, 5e– | 33As 1s22s22p63s23p63d104s24р3 |
| 34Se 2e–, 8e–, 18e–, 6e– | 34Se 1s22s22p63s23p63d104s24р4 |
| 35Br 2e–, 8e–, 18e–, 7e– | 35Br 1s22s22p63s23p63d104s24р5 |
| 36Kr 2e–, 8e–, 18e–, 8e– | 36Kr 1s22s22p63s23p63d104s24р6 |
Парадак размяшчэння 3d- і 4s-арбіталей у атамах вызначаны эксперыментальна. Зыходзячы з гэтых дадзеных, пры адрыве ад атама электронаў ns2-электроны адрываюцца раней, чым (n–1)d-электроны, што прыводзіць да звычайнай для d-элементаў ступені акіслення +2. З гэтага вынікае, што ns-электронны слой з’яўляецца знешнім у адносінах да (n–1)d-электроннага слоя.
Структура перыядычнай сістэмы хімічных элементаў з пункту гледжання будовы атамаў
Асноўнымі структурнымі складнікамі перыядычнай сістэмы хімічных элементаў з’яўляюцца група і перыяд. Група — гэта вертыкальны рад элементаў, размешчаных у парадку ўзрастання зараду ядра іх атамаў, аб’яднаных агульнай прыкметай — аднатыпнай электроннай канфігурацыяй знешняй электроннай абалонкі.
Элементы IА- і IIА-груп адносяць да s-элементаў, паколькі ў іх электроны знешняй абалонкі знаходзяцца на s-падузроўні. Элементы IIIА–VIIIА-груп — адпаведна да p-элементаў. Элементы, размешчаныя ў перыядычнай сістэме паміж s- і p-элементамі ў 4–8-м перыядах, называюцца d- і f-элементамі. У іх электронамі запаўняюцца d- і f-падузроўні перадзнешняй электроннай абалонкі. Такія элементы адносяць да B-груп.
Перыяды — гэта гарызантальныя рады ў перыядычнай сістэме, у якіх хімічныя элементы размешчаны ў парадку павелічэння зараду ядра атама і ліку электронаў на знешнім энергетычным узроўні. У атамаў элементаў 2-га і 3-га перыядаў адбываецца паступовае запаўненне электронамі s-, а затым p-арбіталей.
Кожны перыяд пачынаецца s -элементамі (шчолачныя металы), у атамах якіх электроны запаўняюць новы энергетычны ўзровень. Апошнім элементам у кожным перыядзе з’яўляецца высакародны газ, атамы якога маюць цалкам запоўнены электронамі р-падузровень.
Такім чынам, развіццё тэорыі будовы атама дазволіла даць фізічнае абгрунтаванне перыядычнаму закону і структуры перыядычнай сістэмы хімічных элементаў. У цяперашні час перыядычную сістэму можна разглядаць як натуральную класіфікацыю хімічных элементаў па электронных структурах іх атамаў.
*Становішча ў перыядычнай сістэме d- і f-элементаў
d- і f-Элементы адносяць да элементаў B-груп. Бо гэтыя элементы размешчаны ў перыядычнай сістэме паміж s- і p-элементамі ў 4–8-м перыядах, іх называюць пераходнымі.
У 4-м перыядзе (K — Kr) змяшчаецца 18 элементаў. З прычыны большай колькасці элементаў у гэтым перыядзе ў параўнанні з першымі трыма перыядамі Д. І. Мендзялееў назваў 4-ы і наступныя перыяды вялікімі.
Пяты перыяд (Rb — Xe) пабудаваны аналагічна 4-му: у ім таксама знаходзіцца дзесяць пераходных d-элементаў (Y — Cd).
Шосты перыяд (Cs — Rn) змяшчае 32 элементы. У яго, акрамя дзесяці d-элементаў (Lu — Hg), уключана 14 f-элементаў. Элементы ад лантану (La) да ітэрбію (Yb) у выглядзе асобнага раду вынесены ўніз табліцы, рад атрымаў назву «лантаноіды» па яго першым элеменце — лантане. Лантаноіды падобныя хімічнымі ўласцівасцямі. Гэта тлумачыцца тым, што электронамі ў іх запаўняюцца ўнутраныя 4f-арбіталі, а валентны электронны слой мае падобную электронную канфігурацыю — часцей за ўсё 5d16s2. У злучэннях лантаноіды праяўляюць пераважна ступень акіслення +3.
Сёмы перыяд таксама змяшчае 32 элементы — ад францыю (Fr) да аганесону (Og). Перыяд пачынаецца з s-элементаў (Fr і Ra), потым ідуць 14 актыноідаў (Ac — No). Гэтыя элементы таксама вынесены ў асобны рад унізе табліцы з-за блізкасці іх уласцівасцей, хоць яны выражаныя менш, чым у лантаноідаў. Потым ідуць дзесяць 6d-элементаў і шэсць 6р-элементаў. Усе элементы гэтага перыяду з’яўляюцца радыеактыўнымі, і вялікая іх частка атрымана штучным шляхам.
У перыядычнай сістэме элементы падзелены на групы. Дзве групы IA і IIA запаўняюць s-элементы. Далей размяшчаюцца дзесяць В-груп, запоўненых d-элементамі. Завяршаюць табліцу шэсць А-груп, якія змяшчаюць р-элементы.
Ці можа быць адкрыта яшчэ больш хімічных элементаў, чым вядома цяпер? Бо самыя апошнія з вядомых элементаў былі адкрыты зусім нядаўна.
На гэтае пытанне адказвае тэорыя ядзернай фізікі. Пакуль з надзейнасцю прадказваюць магчымасць існавання хімічных элементаў з парадкавымі нумарамі да 126. У той самы час ёсць навуковыя канцэпцыі, якія бачаць магчымым штучнае атрыманне хімічных элементаў з парадкавымі нумарамі да 173 з «астраўком стабільнасці» ў раёне 164-га элемента.
У перыядычнага закону няма звыклага для фізічных законаў матэматычнага выразу. Усе неаднаразовыя спробы вывесці матэматычную формулу перыядычнага закону былі марнымі. У гэтым асаблівасць уласцівасцей хімічных элементаў і іх злучэнняў. Іх уласцівасці не ўкладваюцца ў простыя матэматычныя выразы.
Своеасаблівай графічнай формай, якая паказвае перыядычны закон, стала перыядычная сістэма, якую Д. І. Мендзялееў прадставіў у выглядзе табліцы. На прапанову ІЮПАК яе так і называюць: «Перыядычная табліца элементаў» (Periodic Table of the Elements), а ў нас часта коратка: «Табліца Мендзялеева».
Табліца перыядычнай сістэмы — гэта ілюстрацыя заканамернага размяшчэння хімічных элементаў адносна адзін аднаго ў перыядычнай сістэме.
Мендзялееў палічыў больш прымальным прадставіць перыядычную сістэму ў кароткаперыяднай форме, якая ў сучасным выглядзе паказана на малюнку 20.1. У ёй групы элементаў падзяляюцца на падгрупы — галоўныя і пабочныя. У галоўных падгрупах размешчаны s- і p-элементы, у пабочных — d-элементы.

Пазней ІЮПАК прапанаваў выкарыстоўваць паўдоўгаперыядны варыянт табліцы, у якім галоўныя і пабочныя падгрупы былі ператвораны ў асобныя А- і В-групы: галоўныя — у А-групы, пабочныя — у В-групы. Такіх груп аказалася 18. Гэтая табліца размешчана на форзацы падручніка.
Існуе варыянт доўгаперыяднай табліцы, у якой f-элементы ўбудаваны ў рад з d-элементамі (мал. 20.2). Існуюць і іншыя варыянты малюнка перыядычнай сістэмы, іх налічваецца каля 500.

Уласцівасці атамаў хімічных элементаў, а таксама састаў і ўласцівасці простых рэчываў і злучэнняў, утвораных імі, знаходзяцца ў перыядычнай залежнасці ад зараду атамных ядраў.
Парадкавы нумар хімічнага элемента роўны ліку пратонаў у ядры атама гэтага элемента.
Нумар А-групы адпавядае ліку электронаў на знешняй электроннай абалонцы атамаў хімічных элементаў дадзенай групы. Элементы, якія знаходзяцца ў адной групе перыядычнай сістэмы, маюць аднолькавую электронную канфігурацыю знешняга электроннага слоя.
Нумар перыяду супадае з колькасцю энергетычных узроўняў, на якіх размешчаны электроны ў атамах усіх элементаў гэтага перыяду.
Пытанні, заданні, задачы
1. Патлумачце на прыкладзе азоту фізічны сэнс парадкавага нумара хімічнага элемента, нумара А-групы, нумара перыяду.
2. Чаму элементы IА- і IIА-груп называюць s-элементамі, а элементы IIIА- і VIIIА-групп — p-элементамі?
3. Пабудуйце электронна-графічныя схемы і запішыце электронныя формулы атамаў хімічных элементаў 3-га перыяду.
4. Чаму ўласцівасці хімічных элементаў і іх злучэнняў падпарадкоўваюцца перыядычнаму закону? Абгрунтуйце свой адказ.
5. Чаму элементы адной групы праяўляюць падабенства ва ўласцівасцях? У чым прычына адрознення ўласцівасцей хімічных элементаў, размешчаных у адной групе?
6. Прааналізуйце прыведзеныя электронна-графічныя схемы, адзначце, якія станы атама з’яўляюцца асноўнымі, а якія ўзбуджанымі:
- а)

- б)

- в)

- г)

- д)

7. Вызначце лік энергетычных узроўняў, на якіх у атамах кіслароду, магнію, кальцыю і свінцу ў асноўным стане размешчаны электроны.
8. Укажыце:
- а) лік электронаў на знешняй электроннай абалонцы ў атамах хімічных элементаў з парадкавымі нумарамі 5, 15, 20, 32, 53;
- б) сімвалы элементаў, у атамах якіх цалкам запоўнены знешнія электронныя абалонкі.
9. Вызначце масу солі, атрыманай пры растварэнні ў кіслаце саставу НЭ металу Ме масай 5 г. Пры гэтым вядома, што элемент, які ўваходзіць у састаў кіслаты мае электронную канфігурацыю [Ne]3s23p5, а электронная схема металу 2е–, 8е–, 2е–.
10. Складзіце электронна-графічную схему атама хімічнага элемента Э, злучэнні якога шырока выкарыстоўваюцца ў сельскай гаспадарцы. Адно з іх мае састаў (ЭН2)2СО, а масавая доля элемента ў ім роўная 46,67 %.
*Самакантроль
1. У перыядычнай залежнасці ад зарада ядра атамаў знаходзіцца:
- а) маса атамаў;
- б) агульная колькасць электронаў у атаме;
- в) электронная канфігурацыя знешняга электроннага слоя;
- г) памеры атамаў.
2. Атаму магнію адпавядаюць формулы электронных канфігурацый:
- а) 1s22s22p63s2;
- б) 1s22s22p63s23p2;
- в) [Ne]3s23p;
- г) [Ne]3s2.
3. Агульная формула электроннай канфігурацыі элементаў IIIА-групы:
- а) ns2np1;
- б) ns2np2;
- в) ns2np3;
- г) ns2np4.
4. Формулы электронных канфігурацый высакародных газаў:
- а) 1s2;
- б) 2s22p6;
- в) 1s22s22p63s23p6;
- г) 1s23s23p63s23p64s2.
5. Два няспараныя электроны на знешнім электронным слоі ў асноўным стане маюць атамы:
- а) С;
- б) N;
- в) О;
- г) Ne.