§ 5. Асноўныя законы хіміі. Закон пастаянства саставу рэчыва. Закон захавання масы рэчыва
Закон захавання масы рэчыва
Закон захавання масы рэчыва дазваляе вылічваць масы рэчываў, якія ўступаюць у рэакцыю або якія ўтвараюцца ў выніку яе працякання.
Нагадаем, што працэс ператварэння адных рэчываў у іншыя без змены агульнай колькасці і прыроды атамаў, з якіх гэтыя рэчывы складаюцца, называюць хімічнай рэакцыяй. Рэчывы, што ўступаюць у хімічную рэакцыю, — гэта рэагенты, а што ўтвараюцца ў выніку хімічнай рэакцыі — гэта прадукты.
Працяканне хімічных рэакцый падпарадкоўваецца закону захавання масы рэчываў: маса рэчываў, якія ўступілі ў хімічную рэакцыю, роўная масе рэчываў, якія ўтварыліся.
Дзеянне закону можна паказаць на наступным прыкладзе. Калі закрытую колбу з невялікай колькасцю фосфару ўзважыць, а потым нагрэць, то фосфар загараецца яркім полымем, а колба напаўняецца белым дымам. Паўторнае ўзважванне паказвае, што агульная маса колбы са змесцівам не змянілася (мал. 10).
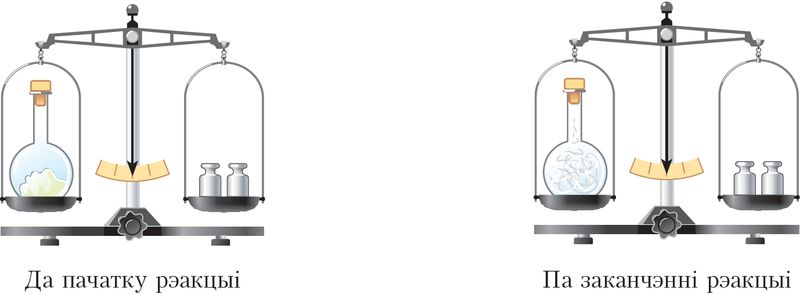
З пазіцыі атамна-малекулярнага вучэння закон можна растлумачыць тым, што пры хімічных рэакцыях атамы не знікаюць і не ўзнікаюць зноў, іх агульны лік застаецца нязменным, а значыць, і сумарныя масы рэчываў да і пасля рэакцыі аднолькавыя.
Вялікі ўклад у эксперыментальны доказ закону захавання масы рэчыва ўнеслі доследы рускага вучонага М. В. Ламаносава і французскага хіміка А. Лавуазье (2-я палова XVIII ст.) па вымярэнні масы зыходных рэчываў і масы прадуктаў, якія з іх атрымліваюцца.
Пакажам, як можна выкарыстоўваць закон захавання масы рэчыва для колькасных разлікаў па ўраўненнях рэакцый на прыкладзе гарэння метану ў кіслародзе з утварэннем вады і вуглякіслага газу.
Схема гэтай рэакцыі:
Перад формуламі паставім каэфіцыенты, якія павінны ўраўнаваць лік атамаў рэагентаў і прадуктаў:
Гэта ўраўненне сведчыць пра тое, што ўтварэнне адной малекулы вуглякіслага газу і дзвюх малекул вады адбываецца, калі адна малекула метану прарэагуе з дзвюма малекуламі кіслароду. Каэфіцыенты паказваюць, у якіх мольных суадносінах рэагуюць рэчывы і ўтвараюцца прадукты.
Так, са складзенага ўраўнення рэакцыі відаць, што калі ў рэакцыю ўступае 1 моль метану, то на яго спальванне выдаткоўваецца 2 моль кіслароду, у выніку ўтвараюцца 2 моль вады і 1 моль вуглякіслага газу.
З улікам гэтых колькасных суадносін можна разлічыць масу (колькасць, аб’ём) рэагентаў, неабходных для атрымання пэўнай колькасці прадуктаў, і наадварот — прадуктаў па зыходных рэчывах.
Прыклад 2. Вызначце масу сульфату алюмінію, які ўтварыўся пры поўным растварэнні алюмінію масай 13,5 г у разбаўленай сернай кіслаце.
Дадзена:
m(Аl) = 13,5 г
m(Al2(SО4)3) — ?
Рашэнне
M(Al) = 27 г/моль; M(Al2(SO4)3) = 342 г/моль.
Колькасць алюмінію, які ўступіў у хімічную рэакцыю:
З улікам ва ўраўненні рэакцыі каэфіцыентаў маем:
адкуль
, гэта значыць
моль.
Масса соли:
m(Al2(SO4)3) = n(Al2(SO4)3) ∙ M(Al2(SO4)3) = 0,25 моль ∙ 342 г/моль = 85,5 г.
Адказ: m(Al2(SO4)3) = 85,5 г.
Прыклад 3. Пры гарэнні магнію масай 1,2 г утварыўся яго аксід масай 2 г. Вызначце аб’ём кіслароду (н. у.), выдаткаванага на гарэнне магнію.
Рашыць такую задачу можна як з дапамогай ураўнення рэакцыі, так і без яго. Разгледзім другі спосаб.
Дадзена:
m(Mg) = 1,2 г
m(MgO) = 2 г
V(O2) — ?
Рашэнне
СЗгодна з законам захавання масы рэчываў, маса рэчываў, якія ўтварыліся, роўная масе рэчываў, якія ўступілі ў хімічную рэакцыю:
Таму маса кіслароду роўная:
а яго колькасць складае:
Аб’ём кіслароду роўны:
Адказ: V(O2) = 0,56 дм3.